Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

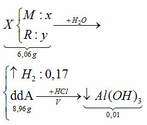
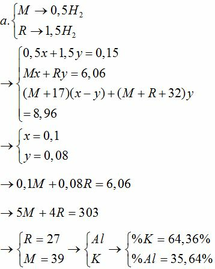
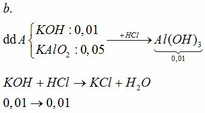
TH1: kết tủa Al(OH)3 chưa bị hòa tan
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,01 ←0,01
→ nHCl = 0,02
→ V = 0,02 (lít) = 20 (ml)
TH2: kết tủa Al(OH)3 bị hòa tan một phần
KAlO2 + HCl +H2O → KCl + Al(OH)3↓
0,05 → 0,05 0,05
Al(OH)3 + 3HCl → AlCl3 + 3H2O
0,04` → 0,12
→ nHCl = 0,18 → V = 0,18 (l) = 180 (ml)
Vậy có 2 giá trị của V thỏa mãn là: 20 ml và 180 ml

Gọi kim loại kiềm đó là M
Khi đốt kim loại kiềm trong kk ta có f. ứ
M+ O2= MO
=>CR A thu được là MO và M dư
Khi cho CR A vào nước ta có f.ứ
M+ H2O= M(OH)2 + H2
MO+ H2O= M(OH)2
=>Dung dịch B là M(OH)2, khí D là CO2
Khi thổi khi CO2 vào dd B ta có f.ứ
CO2+ M(OH)2= MCO3 +H2O
=> Kết tủa Y là MCO3
Khi cho kết tủa Y td dd HCl ta có p.ứ
MCO3 + HCl= MCl2 + CO2+ H2O
=> Dd E là MCl2
Khi cho dd AgNO3 vào dd E ta có p.ứ
AgNO3 + MCl2 = AgCl+ MCO3
=> Lọc kết tủa đc dd AgNO3
AgNO3 + H2SO4 = Ag2SO4+ HNO3
Thử tham khảo nha, k chắc đúng đâu

đốt cháy hoàn toàn m gam fes2 và lấy toàn bộ sản phẩm khí thu đc cho hấp thụ hết bởi 5000 ml dd ca(oh)2 1M thu đc 12g kết tủa đun nóng dd thu đc sau phảm ứng thấy xuất hiện kết tủa nữa. tinh m
Chất khí thoát ra là SO2
\(n_{Ca\left(OH\right)_2}=5\left(mol\right)\)
\(n_{CaSO_3}=0,1\left(mol\right)\)
Do sau khi đun nóng dung dịch thu được kết tủa nữa nên dung dịch là Ca(HSO3)2
Bảo toàn nguyên tố Ca => \(n_{Ca\left(HSO_3\right)_2}=5-0,1=4,9\left(mol\right)\)
Bảo toàn nguyên tố S: \(n_{FeS_2}.2=n_{CaSO_3}.1+n_{Ca\left(HSO_3\right)_2}.2=4,95\left(mol\right)\)
=> \(m_{FeS_2}=4,95.120=594\left(g\right)\)

1/ nNaCl=5,85/58,5=0,1 mol.
nAgNO3=34/170=0,2 mol.
PTPU: NaCl+AgNO3=>AgCl+NaNO3
vì NaCl và AgNO3 phan ung theo ti le 1:1 (nAgNO3 p.u=nNaCl=0,1 mol)
=>AgNO3 du
nAgNO3 du= 0,2-0,1=0,1 mol.
Ta tinh luong san pham theo chat p.u het la NaCl
sau p.u co: AgNO3 du:0,1 mol; AgCl ket tua va NaCl: nAgCl=nNaNO3=nNaCl=0,1 mol.V(dd)=300+200=500ml=0,5 ()l
=>khoi lg ket tua: mAgCl=0,1.143,5=14,35 g
C(M)AgNO3=C(M)NaNO3=n/V=0,1/0,5=0,2 M

a) Khi đi vào dd Ca(OH)2 dư thì chỉ có CO2 phản ứng
CO2 + Ca(OH)2 --> CaCO3↓ + H2O
nCaCO3 = 1/100 = 0,01 mol = nCO2
Khi đi qua CuO dư đun nóng thì chỉ có CO phản ứng
CO + CuO --> CO2 + Cu
nCu = 0,64/64 = 0,01 mol = nCO
b) vậy hỗn hợp gồm CO và CO2 đều có số mol là 0,01 mol
=> % V mỗi khí = 50%
c) 2CO + O2 --> 2CO2
=> nO2 = \(\dfrac{nCO}{2}\)= 0,05 mol
=> Thể tích khí oxi cần dùng để đốt cháy hỗn hợp CO và CO2 là 0,05.22,4 = 1,12 lít.
PTHH
M+H2O=MOH+1/2H2 (1)
A a a a/2
2MOH+CO2=M2CO3+H2O (2)
A a/2 a/2 a
M2CO3 +CO2 +H2O =2MHCO3 (3)
0.3-0.5a 0.3-0.5a 0.3-0.5a 0.6-a
Dd B gồm: M2CO3 có n=a-0.3 và MHCO3 có n=0.6-a
Phần 1:
Ca(NO3)2+M2CO3=CaCO3+2MNO3 (4)
0.1 0.1 0.1 0.2
Từ PTHH 4: 0.5a-0.3+0.5a=0.1 => a=0.5 => M là Na
2MHCO3=M2CO3+CO2+H2O (5)
0.05 0.025 0.025 0.025
M2CO3+Ca(NO3)2=CaCO3+2MNO3 (6)
0.025 0.025 0.025 0.05
=> m=2.5g
V=5.6l
Gọi công thức của tinh thể là
Na2CO3.xH2O
=> x=15
sai sai hay sao ý
0,5a-0,3+0,5a=0,1 sao a lại ra 0,5 dc đáng nhẽ chỗ này phải chia 2 ở về trái trc thì ms ra vì ở P1 mà nó chia đoi
vs cả na2co3.10h2o thôi chứ