Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1.
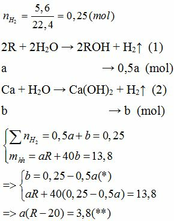
Vì b > 0, từ (*) => a < 0,25/0,5 = 0,5 thế vào (**)
=> R – 20 > 7,6
=> R > 27,6 (***)
Khi cho 8,58 gam R tác dụng với lượng dư HCl thì lượng H2 thoát ra lớn hơn 2,24 (lít)
2R + 2HCl → 2RCl + H2↑ (3)
Theo PTHH (3):
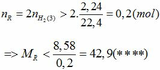
Từ (***) và (****) => 27, 6 < MR < 42,9
Vậy MR = 39 (K) thỏa mãn
2.
Ta có:
=> nKOH = nK = 0,2 (mol)
nCa(OH)2 = nCa = 0,15 (mol)
∑ nOH- = nKOH + 2nCa(OH)2 = 0,2 + 2.0,15 = 0,5 (mol)
Khi cho hỗn hợp Z ( N2, CO2) vào hỗn hợp Y chỉ có CO2 phản ứng
CO2 + OH- → HCO3- (3)
CO2 + 2OH- → CO32- + H2O (4)
CO32- + Ca2+ → CaCO3↓ (5)
nCaCO3 = 8,5/100 = 0,085 (mol) => nCO32-(5) = nCaCO3 = 0,085 (mol)
Ta thấy nCaCO3 < nCa2+ => phương trình (5) Ca2+ dư, CO32- phản ứng hết
TH1: CO2 tác dụng với OH- chỉ xảy ra phản ứng (4)
Theo (4) => nCO2 = nCO32-(4) = nCaCO3 = 0,085 (mol)
=> VCO2(đktc) = 0,085.22,4 = 1,904 (lít)
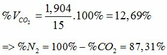
TH2: CO2 tác dụng với OH- xảy ra cả phương trình (3) và (4)
Theo (4): nCO2 = nCO32- = 0,085 (mol)
nOH- (4) = 2nCO32- = 2. 0,085 = 0,17 (mol)
=> nOH- (3)= ∑ nOH- - nOH-(4) = 0,5 – 0,17 = 0,33 (mol)
Theo PTHH (3): nCO2(3) = nOH- = 0,33 (mol)
=> ∑ nCO2(3+4) = 0,085 + 0,33 = 0,415 (mol)
=> VCO2 (ĐKTC) = 0,415.22,4 = 9,296 (lít)
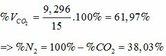

\(n_{H_2SO_4}=0,2.2=0,4\left(mol\right)\)
Fe + H2SO4 → FeSO4 + H2
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Gọi x,y lần lượt là số mol Fe, Al
\(\left\{{}\begin{matrix}56x+27y=11\\x+\dfrac{3}{2}y=0,4\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
=>\(\%m_{Fe}=\dfrac{0,1.56}{11}.100=50,91\%\)
=> %m Al = 100 - 50,91 =49,09 %
b)Theo PT: \(n_{H_2}=n_{H_2SO_4}=0,4\left(mol\right)\)
=> \(V_{H_2}=0,4.22,4=8,96\left(l\right)\)
c) \(CM_{FeSO_4}=\dfrac{0,1}{0,2}=0,5M\)
\(CM_{Al_2\left(SO_4\right)_3}=\dfrac{\dfrac{0,2}{2}}{0,2}=0,5M\)

a)Zn +H2SO4 -> ZnSO4 +H2
Fe +H2SO4 -> FeSO4 +H2
Cu +H2SO4 -> CUSO4+H2
đặt số mol 3 KL Zn, Fe, Cu lần lượt là a, b, c (mol), ta có pt theo đề bài:
65a+56b+64c=21.6 (1)
c=3/64 (2)
a+b=6.72/22.4 (3)
Từ (1)(2)(3)==> a=0.2(mol), b=0.1(mol), c=3/64(mol)
==>%Zn=0.2 x 65 x100/21.6 = 60.185%
%Fe=0.1 x 56 x 100/21.6 = 25.925%
%Cu=100%-( 60.185% + 25.925% )= 13.89%

PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a_____2a______a____a (mol)
\(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
b_____2b_______b____b (mol)
Ta lập hệ phương trình: \(\left\{{}\begin{matrix}56a+24b=10,4\\a+b=\dfrac{6,72}{22,4}=0,3\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,1\cdot56}{10,4}\cdot100\%\approx53,85\%\\\%m_{Mg}=46,15\%\\C_{M_{FeCl_2}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\\C_{M_{MgCl_2}}=\dfrac{0,2}{0,2}=1\left(M\right)\end{matrix}\right.\)

Goi nFe=x,nR=y.
56x+Ry=11,3.
X+y=0,3.
Tu 2 pt=>R<37,6.(1).
Thi ngiem 2.
=>nH2S04<0,4.
=>12<R.(2).
Tu 1 va 2=>
12<R<37,6.
R htri 2=>R la Mg.

Gọi x,y là số mol của AI và Fe
2Al + 3H2SO4 -> Al2(SO4)3 + 3H2
x --------------------... \(\frac{3x}{2}\)
Fe + H2SO4 -> FeSO4 + H2
y ----------------------> y
n H2 = 0,56 / 22,4 = 0,025 mol
Ta có hệ \(\begin{cases}27x+56y=0,83\\x+\frac{3x}{2}=0,025\end{cases}\)
\(\begin{cases}x=0,01mol\\y=0,01mol\end{cases}\)
=> m Al = 0,01 x 27 = 0,27 g
=> m Fe = 0,01 x 56 = 0,56 g
=> % Al = 0,27 / 0,83 x 100% = 32,53 %
=> % Fe = 0,56 / 0,83 x 100% = 67,47 %

m rắn giảm = mO (oxit) => nO (oxit) = (1,6 – 1,408) : 16 = 0,012mol
Dễ thấy n = nO (oxit) = 0,012mol
=> nH2 ban đầu = 0,012 : 80% = 0,015
=> nFe = nH2= 0,015 → x = 0,015
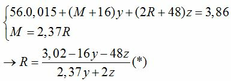
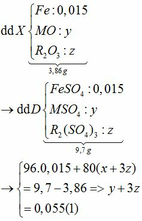
Ta có: CO + O(Oxit) → CO2
Vì: m(Rắn giảm) = mO(Oxit) → nO(Oxit) = (3,86 – 3,46) : 16 = 0,025
TH1: cả 2 oxit đều bị khử bởi CO
→ nO(Oxit) = y + 3z = 0,025 kết hợp với (1) loại
TH2: chỉ có MO bị khử bởi CO
→ nO(Oxit) = nMO = 0,025 → y = 0,025 kết hợp với (1) => z = 0,01
Kết hợp với (*) => M = 64 (Cu)
TH3: chỉ có R2O3 bị khử bởi CO
→ nO(Oxit) = 3.nR2O3 → z = 0,025/3 kết hợp với (1) => y = 0,03
Kết hợp với (*) y => M lẻ => loại
Vậy %m các chất trong X là: 21,76%; 51,81%; 26,43%

PTHH:
Zn + H2SO4 ---> ZnSO4 + H2 (1)
2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2 (2)
Ta có: \(n_{H_2}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
Gọi x, y lần lượt là số mol của Zn và Al
a. Theo PT(1): \(n_{H_2}=n_{Zn}=x\left(mol\right)\)
Theo PT(2): \(n_{H_2}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}y\left(mol\right)\)
=> \(x+\dfrac{3}{2}y=0,8\) (*)
Theo đề, ta có: 65x + 27y = 3,79 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}x+\dfrac{3}{2}y=0,8\\65x+27y=3,79\end{matrix}\right.\)
(Ra số âm, bn xem lại đề nhé.)
a)Thí nghiệm 2 :
$2R + O_2 \xrightarrow{t^o} 2RO$
n O2 = 1,12/22,4 = 0,05(mol)
n R < 2 n O2 = 0,1(mol)
=> R > 3/0,1 = 30(1)
Thí nghiệm 2 : n H2 = 5,6/22,4 = 0,25(mol)
n R = a(mol)
$Fe + H_2SO_4 \to FeSO_4 + H_2$
$R + H_2SO_4 \to RSO_4 + H_2$
n Fe = 0,25 - a(mol)
Suy ra :
(0,25 - a).56 + Ra = 11,6
=> R = (56a - 2,4)/a
Mà 0 < a < 0,25
Suy ra : R < 46,6(2)
Từ (1)(2) suy ra : 30 < R < 46,6
Suy ra R là Ca(R = 40)
b) (0,25 -a)56 + 40a = 11,6
=> a = 0,15
%m Ca = 0,15.40/11,6 .100% = 51,72%
%m Fe = 100% -51,72% = 48,28%
3/0,1 vậy 3 là gì ạ