
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

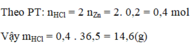

a. PTHH: Zn + 2HCl → ZnCl2 + H2
nZn = 13 : 65 = 0,2 (mol)
b.Theo PT: nHCl = 2 nZn = 2. 0,2 = 0,4 mol
Vậy mHCl = 0,4 . 36,5 = 14,6(g)
c. Theo PTHH: nH2 = nZn = 0,2 mol
VH2 (đktc) = 0,2 . 22,4 = 4,48 (l)
a,PTHH: Zn+2HCl--->ZNCl2+H2
b,nZn=0,2mol
=>2nZn = nHCl = 0,4 mol
=>mHCl= 0,4.36,5= 14,6 (g)
c,nH2 = 0,2 (nH2 = nZn)
=>VH2 = 4,48l

$PTHH:Zn+2HCl\to ZnCl_2+H_2\uparrow$
$n_{Zn}=\dfrac{13}{65}=0,2(mol)$
Theo PT: $n_{ZnCl_2}=n_{H_2}=0,2(mol);n_{HCl}=0,4(mol)$
$a)m_{axit}=m_{HCl}=n.M=0,4.36,5=14,6(g)$
$b)m_{ZnCl_2}=n.M=0,2.136=27,2(g)$
$c)V_{H_2(đktc)}=n.22,4=0,2.22,4=4,48(lít)$
Số mol kẽm là :
\(n=\dfrac{m}{M}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH : Zn + 2HCL -> ZnCl2 + H2
1 2 1 1
0,2 mol -> 0,4 mol 0,2 mol 0,2 mol
a, Khối lượng HCL là :
\(m=n.M=0,4.35,5=14,2\left(g\right)\)
b, Khối lượng ZnCL2 là :
\(m=n.M=0,1.136=13,6\left(g\right)\)
c, Thể tích H2 là : V = n . 22,4 = \(0,1.22,4=2,24\left(l\right)\)

nZn = \(\dfrac{13}{65}\)= 0,2mol
Zn + 2HCl -> ZnCl2 + H2
0,2->0,4 ->0,2
=>mHCl = 0,4 . 36,5 = 14,6 g
=>VH2 = 0,2 . 22,4 = 4,48 (l)
a) ta có nZn= \(\dfrac{13}{65}\)= 0,2( mol)
PTPU
Zn+ 2HCl\(\rightarrow\) ZnCl2+ H2
0,2...0,4.....................0,2..
b) mHCl= 0,4. 36,5=14,6( g)
c) VH2= 0,2. 22,4= 4,48( lít)

nZn=13:65=0.2 mol
PTHH:
Zn + 2HCl -----> ZnCl2 + H2
0,2--->0.4---------->0.2----->0.2
mHCl=0,2.36,5=14,6gam
VH2=0,2.22,4=4,48 lít
Cho 13g Zn tác dụng với HCl theo sơ đồ phản ứng
Zn + 2HCl ----> ZnCl + H2 ↑
a, Lập phương trình hóa học
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
b, Tính khối lượng HCl đã tham gia phản ứng
\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{13}{65}=0,2\left(mol\right)\)
\(\Rightarrow m_{HCl}=n_{HCl}.M_{HCl}=0,2.36,5=7,3\left(g\right)\)
c, Tính thể tích khí H2 đã sinh ra sau phản ứng
\(V_{H_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\)

PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
___0,3____0,6_____0,3____0,3 (mol)
a, \(m_{Zn}=0,3.65=19,5\left(g\right)\)
b, \(m_{HCl}=0,6.36,5=21,9\left(g\right)\)
c, \(m_{ZnCl_2}=0,3.136=40,8\left(g\right)\)
Bạn tham khảo nhé!