Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Các phương trình phản ứng :
M tác dụng với O2: 4 M + 2 n O 2 → t 0 2 M n O n
Chất rắn sau phản ứng tác dụng với dung dịch HCl thu được khí H2, chứng tỏ chất rắn sau có M dư nên O2 hết - chất rắn sau gồm M dư và M2On :
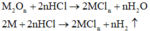
Tính toán:
Số mol H2 thu được là: n H 2 = 13 , 44 22 , 4 = 0 , 6 m o l
Sơ đồ phản ứng:
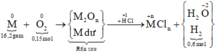
Các quá trình nhường, nhận electron cho cả quá trình:
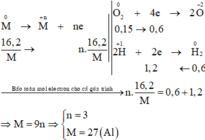

Hòa tan hoàn toàn 15,2 gam hỗn hợp gồm Fe và Cu trong dung dịch HNO3, thu được dung dịch X và 4,48 lút khí NO. Cho 3,96 gam kim loại Mg vào X đến khi phản ứng xảy ra hoàn toàn, thu được 224ml khí NO và m gam chất rắn không tan. biết NO là sản phẩm khử duy nhất của N+5. Gía trị cảu m là
A. 6,4 B.12,8 C.9,6 D.4,8

đây ạ
nFe = 8.4/56=0.15 mol
nCu = 6.4/64=0.1 mol
nAgNO3 = 0.35*2=0.7 mol
Fe + 2AgNO3 --> Fe(NO3)2 + 2Ag
0.15___0.3________0.15_____0.3
Cu + 2AgNO3 --> Cu(NO3)2 + 2Ag
0.1____0.2________0.1_______0.2
nAgNO3( còn lại ) = 0.7 - 0.3 - 0.2 = 0.2 mol
Vì : AgNO3 còn dư nên tiếp tục phản ứng với Fe(NO3)2
Fe(NO3)2 + AgNO3 --> Fe(NO3)3 + Ag
Bđ: 0.15________0.2
Pư: 0.15________0.15_______________0.15
Kt: 0___________0.05_______________0.15
Chất rắn : 0.65 (mol) Ag
mAg = 0.65*108 = 70.2g

Đáp án B
Khí thi được là
![]()
Cu là kim loại đứng sau hiđro trong dãy hoạt động hóa học, do đó Cu không tác dụng với dung dịch H 2 SO 4 loãng => Chất rắn không tan là Cu
Sơ đồ phản ứng:


nH2=4,48/22,4=0,2 mol
Fe +2HCl -->FeCl2+H2
0,2 0,2 mol
=>mFe=0,2*56=11,2 g
nSO2=10,08/22,4=0,45 mol
gọi số mol của Cu là a mol
bảo toàn e ta có
Cu\(^0\)-->Cu\(^{+2}\)+2e
a 2a S\(^{+6}\) + 2e -->S\(^{+4}\)
Fe\(^0\)--> Fe\(^{+3}\)+3e 0,45 0,9
0,2 0,6
=>a=0,15=>mCu=0,15*64=9,6 g
=>mhh=9,6+11,2=20,8g
=>%Cu=9,6*100/20,8=46,15%
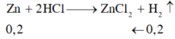



Đáp án D.
Chất rắn không tan là Cu.
Zn + 2HCl → ZnCl2 + H2
0,2 ← 0,2 (mol)
mZn = 0,2.65 = 13 (g) => mCu = 15 – 13 = 2 (g)