Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Ta có: mFe = 40%.m = 0,4m (g) → mCu = m - 0,4m = 0,6m (g)
Sau phản ứng còn 0,65m (g) kim loại > mCu = 0,6m (g)
Khối lượng Fe còn dư: 0,65m - 0,6m = 0,05m (g)
Vậy: mFe phản ứng = 0,4m - 0,05m = 0,35m (g)
Do Fe còn dư sau phản ứng nên tạo thành muối Fe2+
Quá trình nhường electron:
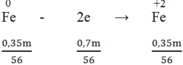
Quá trình nhận electron:
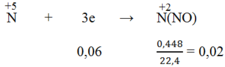
Áp dụng định luật bảo toàn electron, ta có:
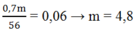
Ta có:
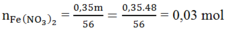
![]()

Đáp án C
Ta có: nCO = 0,8 mol; = 0,9 mol
Gọi n là hóa trị của kim loại M (1 ≤ n ≤ 3)
Trong phản ứng giữa M với H2SO4 đặc nóng, M là chất khử nhường electron.
H2SO4 đặc là chất oxi hóa nhận electron:

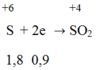
Trong phản ứng khử oxit kim loại bởi CO ta luôn có:
nO (trong oxit) = nCO = 0,8 mol
⇒Tỉ lệ:
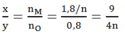
Dựa vào các đáp án ta thấy n = 2 hoặc n = 3


Đáp án B
Ta có:
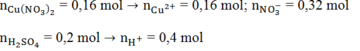
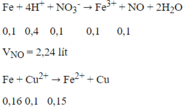
Do Fe nên tiếp tục xảy ra phản ứng:

nFe phản ứng = 0,1 + 0,05 + 0,16 = 0,31 mol
0,6m (g) hỗn hợp bột kim loại sau phản ứng gồm Fe dư và Cu sinh ra:
m - mFe pư + mCu = 0,6m → m - 0,31.56+ 64.0,16 = 0,6m
m = 17,8 (g)

Đáp án C
Gọi M là kim loại nhóm II, số mol là x
M + 2HCl " MCl2 + H2
x(mol) x(mol)
Theo đề bài ra ta có hệ phương trình: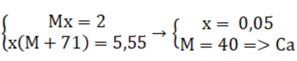

Đáp án B
Khối lượng kim loại phản ứng là:
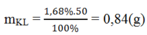
Số mol H2 là:
![]()
2M + 2nHCl → 2MCln + nH2
Số mol của M là:
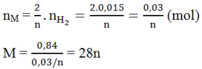
⇒ M = 28n ⇒ n = 2, M = 56 ⇒ M: Fe
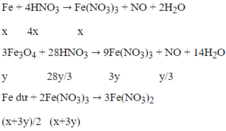
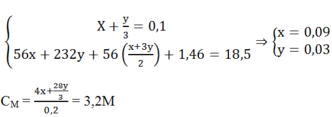
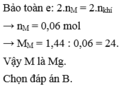
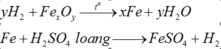
Đáp án B
Số mol NO là:
→ n = 2; M = 64 → M: Cu