

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



xFe ----------------->FexOy
1/56 mol ----------> 1/56x
=> 1/56x(56x + 16y) > 1,41
=> \(\dfrac{16y}{56x}\)> 0,41 => y:x > 1,435 => x = 2 và y = 3 là thỏa mãn. vậy Oxit là Fe2O3

a, \(2Fe+O_2\underrightarrow{t^o}2FeO\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(4Fe+3O_2\underrightarrow{t^o}2Fe_2O_3\)
\(2Fe+6H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
\(2FeO+4H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+SO_2+4H_2O\)
\(2Fe_3O_4+10H_2SO_{4\left(đ\right)}\underrightarrow{t^o}3Fe_2\left(SO_4\right)_3+SO_2+10H_2O\)
\(Fe_2O_3+3H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3H_2O\)
b, Ta có: mO2 = 3,2 (g) \(\Rightarrow n_{O_2}=\dfrac{3,2}{32}=0,1\left(mol\right)\)
\(n_{SO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
BT e, có: 3nFe = 4nO2 + 2nSO2
⇒ nFe = 0,2 (mol)
⇒ mFe = 0,2.56 = 11,2 (g)

*Sửa đề: Tính %m của Oxi
Với bài này thì ko cần viết phương trình đâu bạn nhé :))
Coi hỗn hợp A gồm Fe (a mol) và O (b mol) \(\Rightarrow56a+16b=49,6\) (1)
Ta có: \(n_{SO_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Bảo toàn electron: \(3n_{Fe}=2n_O+2n_{SO_2}\) \(\Rightarrow3a-2b=0,8\) (2)
Từ (1) và (2) \(\Rightarrow\) \(\left\{{}\begin{matrix}a=0,7\\b=0,65\end{matrix}\right.\) \(\Rightarrow\%m_O=\dfrac{0,65\cdot16}{49,6}\cdot100\%\approx20,97\%\)

Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{O_2}=b\left(mol\right)\end{matrix}\right.\)
=> 56a + 32b = 15,84
nO(oxit) = nCO = 0,22 (mol)
=> 2b = 0,22
=> b = 0,11 (mol)
=> a = 0,22 (mol)
2Fe0 -6e --> Fe2+3
0,22->0,66
O20 + 4e --> 2O-2
0,11->0,44
S+6 + 2e --> S+4
2nSO2 <-nSO2
Bảo toàn e: 2nSO2 + 0,44 = 0,66
=> nSO2 = 0,11 (mol)
=> \(V_{SO_2}=0,11.22,4=2,464\left(l\right)\)
=> D
okok, vậy bn có thể lm nnay nhé
bn thử check lại xem ở mA là 15,48g hay 15,84g
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{O_2}=b\left(mol\right)\end{matrix}\right.\)
=> 56a + 32b = 15,84
nO(oxit) = nCO = 0,22 (mol)
=> 2b = 0,22
=> b = 0,11 (mol)
=> a = 0,22 (mol)
\(Fe+O_2\rightarrow A\left\{{}\begin{matrix}Fe\\FeO\\Fe_2O_3\\Fe_3O_4\end{matrix}\right.+H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+SO_2+H_2O\)
- Nếu là 15,84g
Gọi số mol SO2 là a (mol)
Bảo toàn Fe: \(n_{Fe_2\left(SO_4\right)_3}=0,11\left(mol\right)\)
Bảo toàn S: \(n_{H_2SO_4}=3.0,11+a=0,33+a\left(mol\right)\)
Bảo toàn H: \(n_{H_2O}=0,33+a\left(mol\right)\)
Theo ĐLBTKL: \(m_A+m_{H_2SO_4}=m_{Fe_2\left(SO_4\right)_3}+m_{SO_2}+m_{H_2O}\)
=> 15,84 + 98(0,33+a) = 0,11.400 + 64a + 18(0,33+a)
=> a = 0,11
=> VSO2 = 0,11.22,4 = 2,464 (l)
=> D

Ta có:
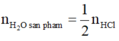
Tương tự bài 1, ta có:
m 5 o x i t + m H C l = m m u o i + m H 2 O s a n p h a m
m
m
u
o
i
=
m
5
o
x
i
t
+
m
H
C
l
-
m
H
2
O
s
a
n
p
h
a
m
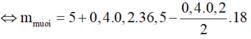
⇔ m m u o i = 7,2g
⇒ Chọn C.

Gọi CTTQ của ox sắt là FexOy
PTHH ; \(Fe_xO_y+yCO\underrightarrow{t^o}xFe+yCO_2\) (1)
\(56x+16y\left(g\right)\)________________ymol
__11,6g____________________0,2mol
Vì Ca(OH)2 dư nên xảy ra pư tạo muối TH
\(CO_2\left(0,2\right)+Ca\left(OH\right)_2\rightarrow CaCO_3\left(0,2\right)+H_2O\)
\(n_{CaCO_3}=0,2mol\)
(1) => 11,2x + 3,2y = 11,6y
=> 11,2x = 8,4y
=> \(\dfrac{x}{y}=\dfrac{3}{4}\)
=> CTHH là Fe3O4
Câu 1 có thiếu đề ko bạn?
Gọi CTTQ của ox sắt là FexOy
\(PTHH:\left(\dfrac{0,03}{y}\right)Fe_xO_y+2yHCl\left(0,06\right)\rightarrow xFeCl_{\dfrac{2y}{x}}+yH_2O\)
\(n_X=\dfrac{1,6}{56x+16y}\left(mol\right)\)
\(\Rightarrow\dfrac{0,03}{y}=\dfrac{1,6}{56x+16y}\)
\(\Rightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
=> CTTh của X là Fe2O3

a.3Fe + 2O2 → Fe3O4
Số nguyên tử Fe : số nguyên tử O2 : số phân tử Fe3O4 = 3:2:1
b.Áp dụng ĐLBTKL ta có: m Fe + m O2 = m Fe3O4 = 8,4 + 3,2 =11, 6 gam
-số mol Fe=0,15mol
-số mol O2=0,1mol
3Fe+2O2\(\rightarrow\)Fe3O4
Tỉ lệ; số nguyên tử Fe:số phân tử O2: số phân tử Fe3O4=3:2:1
Tỉ lệ:\(\dfrac{0,15}{3}=\dfrac{0,1}{2}=0,05\)nên 2 chất phản ứng vừa đủ với nhau nên sản phẩm tính theo 1 trong 2 chất tham gia hoặc BTKL:
BtKL: moxit=8,4+3,2=11,6g