Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 8:
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{2}< \dfrac{0,2}{1}\), ta được O2 dư.
Theo PT: \(\left\{{}\begin{matrix}n_{O_2\left(pư\right)}=\dfrac{1}{2}n_{H_2}=0,05\left(mol\right)\\n_{H_2O}=n_{H_2}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{O_2\left(dư\right)}=0,15\left(mol\right)\)
\(\Rightarrow V_{O_2\left(dư\right)}=0,15.22,4=3,36\left(l\right)\)
\(m_{H_2O}=0,1.18=1,8\left(g\right)\)
Bạn tham khảo nhé!
Câu 9:
a, PT: \(2R+O_2\underrightarrow{t^o}2RO\)
Theo ĐLBT KL, có: mR + mO2 = mRO
⇒ mO2 = 4,8 (g)
\(\Rightarrow n_{O_2}=\dfrac{4,8}{32}=0,15\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,15.22,4=3,36\left(l\right)\)
b, Theo PT: \(n_R=2n_{O_2}=0,3\left(mol\right)\)
\(\Rightarrow M_R=\dfrac{19,2}{0,3}=64\left(g/mol\right)\)
Vậy: M là đồng (Cu).
Câu 10:
Ta có: mBaCl2 = 200.15% = 30 (g)
a, m dd = 200 + 100 = 300 (g)
\(\Rightarrow C\%_{BaCl_2}=\dfrac{30}{300}.100\%=10\%\)
⇒ Nồng độ dung dịch giảm 5%
b, Ta có: \(C\%_{BaCl_2}=\dfrac{30}{150}.100\%=20\%\)
⇒ Nồng độ dung dịch tăng 5%.
Bạn tham khảo nhé!

a. \(n_{H_2}=\dfrac{1.12}{22,4}=0,05\left(mol\right)\)
\(n_{O_2}=\dfrac{2.24}{22,4}=0,1\left(mol\right)\)
PTHH : 2H2 + O2 ---to---> 2H2O
0,05 0,025 0,05
b. Ta thấy : 0,05 < 0,1 => H2 đủ , O2 dư
\(V_{O_2\left(dư\right)}=\left(0,1-0,025\right).22,4=1,68\left(l\right)\)
c. \(m_{H_2O}=0,05.18=0,9\left(g\right)\)
Ta có
nH2 = 1,12 / 22,4 = 0,05 ( mol )
nO2 = 0,1 ( mol )
2H2 + O2 ---to ---> 2H2O
có : 0,05 0,1
pư : 0,05 0,025 0,05
dư : 0 0,075
Xét tỉ lệ : 0,05 / 2 < 0,1 / 1 , ta được O2 dư
=> nO2 dư = 0,1 - 0,025 = 0,075 ( mol )
=> V = 0,075 . 22,4 = 1,68 ( l )
mH2O = 0,05 . 18 = 0,9 ( g )

Gọi số mol Na, Zn là a, b
=> 23a + 65b = 14,3
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
- Nếu Zn tan hết
PTHH: 2Na + 2H2O --> 2NaOH + H2
______a-------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
__2b<----b-------------------->b
=> \(\left\{{}\begin{matrix}2b\le a\\0,5a+b=14,3\end{matrix}\right.\) => Loại
=> Zn không tan hết => NaOH hết
PTHH: 2Na + 2H2O --> 2NaOH + H2
______a------------------->a---->0,5a
2NaOH + Zn --> Na2ZnO2 + H2
_a--------------------------->0,5a
=> 0,5a + 0,5a = 0,1
=> a = 0,1
=> mNa = 0,1.23 = 2,3 (g)
=> mZn = 14,3 - 2,3 = 12(g)

Đáp án A
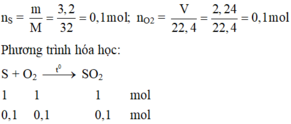
Theo phương trình hóa học S và O 2 phản ứng hết; Sau phản ứng thu được 0,1 mol S O 2 .
m S O 2 = 0 , 1 . ( 32 + 16 . 2 ) = 6 , 4 g a m .

Bài 15:
a) \(n_{O_2}=\dfrac{12,395}{24,79}=0,5\left(mol\right)\)
PTHH: 2H2O --đp--> 2H2 + O2
1<--------------0,5
=> \(H=\dfrac{1.18}{22,5}.100\%=80\%\)
b) \(n_{H_2O}=\dfrac{81}{18}=4,5\left(mol\right)\)
PTHH: 2H2 + O2 --to--> 2H2O
4,5<------------4,5
=> \(V_{H_2\left(lý.thuyết\right)}=4,5.24,79=111,555\left(l\right)\)
=> \(V_{H_2\left(tt\right)}=\dfrac{111,555.100}{90}=123,95\left(l\right)\)
c) \(n_{H_2}=\dfrac{30,9875}{24,79}=1,25\left(mol\right)\)
PTHH: 2H2O --đp--> 2H2 + O2
1,25<-------1,25
=> \(m_{H_2O\left(lý.thuyết\right)}=1,25.18=22,5\left(g\right)\)
=> \(m_{H_2O\left(tt\right)}=\dfrac{22,5.100}{75}=30\left(g\right)\)

\(n_{H_2O}=\dfrac{22,5}{18}=1,25\left(mol\right)\)
\(n_{O_2}=\dfrac{12,395}{24,79}=0,5mol\)
\(2H_2O\rightarrow\left(điện.phân\right)2H_2+O_2\)
1,25 0,5 ( mol ) ( thực tế )
1 0,5 ( mol ) ( lý thuyết )
\(H=\dfrac{1}{1,25}.100=80\%\)
b.\(n_{H_2O}=\dfrac{81}{18}=4,5\left(mol\right)\)
\(2H_2+O_2\rightarrow\left(t^o\right)2H_2O\)
4,5 4,5 ( mol )
\(V_{H_2}=4,5.24,79:90\%=123,95l\)
c.\(n_{H_2}=\dfrac{30,9875}{24,79}=1,25mol\)
\(2H_2O\rightarrow\left(điện.phân\right)2H_2+O_2\)
1,25 1,25 ( mol )
\(m_{H_2O}=1,25.18:75\%=30g\)

Bài 1:
a, \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
Theo PT: \(n_{CuO}=n_{Cu}=0,1\left(mol\right)\Rightarrow m_{CuO}=0,1.80=8\left(g\right)\)
\(\Rightarrow m_{Fe_2O_3}=32-m_{CuO}=24\left(g\right)\)
Bài 2:
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\), \(n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PT: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Xét tỉ lệ: \(\dfrac{0,1}{2}< \dfrac{0,3}{1}\), ta được O2 dư.
Theo PT: \(n_{H_2O}=n_{H_2}=0,1\left(mol\right)\Rightarrow m_{H_2O}=0,1.18=1,8\left(g\right)\)
bài 1
a)PTHH:CuO+H2➞Cu+H2O
PTHH:Fe2O3+3H2➞2Fe+3H2O
b)nCuO=\(\dfrac{32}{80}\)=0,4(m)
nCu=\(\dfrac{6,4}{64}\)=0,1(m)
PTHH : CuO + H2 ➞ Cu + H2O
tỉ lệ :1 1 1 1
số mol
ban đầu:0,4 0,1
ta có tỉ lệ:\(\dfrac{0,4}{1}\)>\(\dfrac{0,1}{1}\)=>CuO dư
PTHH : CuO + H2 ➞ Cu + H2
số mol:0,1 0,1 0,1 0,1
m\(_{CuO}\)=0,1.80=8(g)
bài 2
n\(_{H_2}\)=\(\dfrac{2,24}{22,4}\)=0,1(m)
n\(_{O_2}\)=\(\dfrac{6,72}{22,4}\)=0,3(m)
PTHH : 2H2 + O2 ➞ 2H2O
tỉ lệ : 2 1 2
số mol
ban đầu:0,1 0,3
ta có tỉ lệ:\(\dfrac{0,1}{2}\)<\(\dfrac{0,3}{1}\)=>O2 dư
PTHH : 2H2 + O2 ➞ 2H2O
tỉ lệ :2 1 2
số mol:0,1 0,05 0,1
m\(_{H_2O}\)=0,1.18=1,8(g)

a, \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
b, \(n_{H_2}=\dfrac{2,8}{22,4}=0,125\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{H_2}=0,0625\left(mol\right)\Rightarrow V_{O_2}=0,0625.22,4=1,4\left(l\right)\)
\(n_{H_2O}=n_{H_2}=0,125\left(mol\right)\Rightarrow m_{H_2O}=0,125.18=2,25\left(g\right)\)
Số mol của 2,8 lít khí H2
nH2 = \(\dfrac{V}{22,4}\) = \(\dfrac{2,8}{22,4}\) = 0.125 mol
a. PTHH: 2H2 + O2 \(\rightarrow\) 2H2O
Tỉ lệ: 2 1 2
Mol: 0.125 \(\rightarrow\) 0.1 \(\rightarrow\) 0.125
b. Thể tích khí O2 ở đktc
VO2 = n . 22,4 = 0.1 . 22,4 = 2,24 (l)
Khối lượng H2O thu được
mH2O = n . M = 0.125 . 18 = 2,25g

\(n_{O_2}=\dfrac{1,28}{32}=0,04\left(mol\right);n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ PTHH:2H_2+O_2\rightarrow\left(t^o\right)2H_2O\\ Vì:\dfrac{0,1}{2}>\dfrac{0,04}{1}\Rightarrow H_2dư\\ n_{H_2O}=2.n_{O_2}=2.0,04=0,08\left(mol\right)\\ m_{H_2O}=0,08.18=1,44\left(g\right)\)
\(V_{H_2}=2,24\left(l\right)\Rightarrow n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(PTHH:2H_2+O_2\underrightarrow{đp}2H_2O\)
\(pt:\) \(2mol\) \(2mol\)
\(đb:\) \(0,1mol\) \(\rightarrow\) \(0,1mol\)
\(\Rightarrow n_{H_2O}=0,1mol\)
\(m_{H_2O}=n_{H_2O}.M_{H_2O}=0,1.\left(2.H+1.O\right)=0,1.\left(2.1+1.16\right)=1,8\left(g\right)\)