
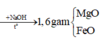

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.





| CHÚ Ý |
| Với bài toán này nếu bạn nào đã học các khóa học với thầy hoặc đọc sách thầy viết thì các em sẽ thấy ngay có sự đổi điện tích âm 2a mol |

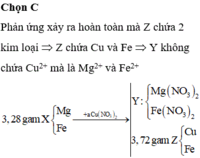
Chọn đáp án A
n M g = 0 , 15 mol; n Fe = 0 , 1 mol. Ta thấy nếu phản ứng xảy ra vừa đủ thì:
m E = m MgO + m Fe 2 O 3 = 0 , 15 x 40 + 0 , 1 ÷ 2 x 160 = 14 gam < 18 gam.
⇒ A chứa Cu2+ dư ⇒ m CuO = 18 - 14 = 4 gam ⇒ n Cu 2 + dư = n CuO = 0 , 05 mol.
A chứa Mg2+, Fe2+, Cu2+, N O 3 - . Bảo toàn điện tích: n NO 3 - = 0 , 6 mol.
⇒ a + 2 a = 0 , 6 ⇒ a = 0 , 2 mol ⇒ B gồm 0,2 mol Ag và (0,2 – 0,05 = 0,15) mol Cu.
⇒ m = 0,2 × 108 + 0,15 × 64 = 31,2 gam

Chọn đáp án B
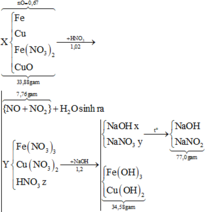
Ta có: 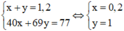
đặt z là nHNO3 dư, BTNT.H Þ nH2O sinh ra = 0,51 – 0,5z
BTNT.N Þ n N O 3 - trong muối của Y là 1 – z = nOH trong kết tủa
Þm Kim loại = 34,58 – 17x(1-z) gam
BTKL Þ 33,88 + 1,02x63 = 34,58 - 17x(l - z) + z + 62 + 7,76 + (0,51 - 0,5z)xl8 Þ z = 0,18

BTNT.N Þ nFe(NO3)2 = (0,09 + 0,11 + 1 -1,02)/2 = 0,09 Þ nFe = 0,14 - 0,09 = 0,05
Vậy %m Fe trong X ![]()

Chọn đáp án C
Giả sử KOH tác dụng với X thì KOH hết ⇒ n KNO 3 = n KOH = 0 , 5 mol.
⇒ m KNO 3 = 0 , 5 x 101 = 50 , 5 gam gam > 41,05 gam ⇒ vô lí ⇒ KOH dư.
Đặt n KOH dư = x mol; n KNO 3 = y mol
![]()
Phản ứng:
![]()
Giải hệ có: x = 0,05 mol; y = 0,45 mol
![]()
Đặt n Fe = a mol; n Cu = b mol ⇒ m A = 56 a + 64 b = 11 , 6 gam.
Do KOH dư ⇒ kết tủa hết ion kim loại ⇒ nung T thì rắn gồm Fe2O3 và CuO.
⇒ mrắn = 41,05 = 0,5a × 160 + 80b. Giải hệ có: a = 0,15 mol; b = 0,05 mol.
Quy hỗn hợp B về N và O. Bảo toàn nguyên tố nitơ có nN spk = 0,7 – 0,45 = 0,25 mol.
![]()
⇒ dung dịch chứa ion Fe2+, Fe3+ và H+ hết.!
Bảo toàn nguyên tố hidro có n H 2 O = 0 , 7 ÷ 2 = 0 , 35 mol.
⇒ bảo toàn nguyên tố oxi có nO sk = 0,7 × 3 – 0,45 × 3 – 0,35 = 0,4 mol.
⇒ BTKL mdung dịch sau phản ứng = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2 gam.
![]()