Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Phương trình hóa học:
Mg + CuSO4 → MgSO4 + Cu (1)
Fe + CuSO4 → FeSO4 + Cu (2)
Có: nMg = 0,01 mol và nFe = 0,02 mol
Theo (1) và (2), nếu Mg và Fe phản ứng hết thì thu được 0,03 mol Cu.
Khối lượng kim loại thu được sau phản ứng là:
0,03 .64 = 1,92 (gam)
Thực tế chỉ thu được 1,88 gam kim loại. Chứng tỏ kim loại đã cho không phản ứng hết.
Mg có tính khử mạnh hơn Fe nên phản ứng trước.
Lượng Cu sinh ra ở (1) là 0,01 mol tương ứng với khối lượng 0,64 (gam)
Khối lượng Fe dư và Cu sinh ra ở (2) là: 1,88 – 0,64 = 1,24 (gam)
Đặt khối lượng Fe tham gia ở (2) là x, khối lượng sắt dư là (1,12 – 56x) và khối lượng Cu sinh ra ở (2) là 64x.
Ta có: (1,12-56x) + 64x = 1,24 => x = 0,015
Lượng CuSO4 trong 250 ml dung dịch đã phản ứng hết:
0,015 + 0,01 = 0,025(mol)
Nồng độ mol của dung dịch đã dùng là : 0,025/0,25 = 0,1mol/l

Đáp án C
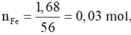
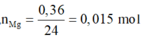
Nếu Fe và Mg phản ứng hết:
![]()
=> mCu = 64.0,045 = 2,88 g > 2,82 g
=> Chứng tò Fe phản ứng còn dư.
![]()
![]()
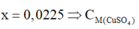
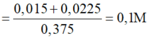

Đáp án A

→ n O H - = 0 , 1 m o l
n a . a = 0 , 1 m o l
Nhận thấy n a . a = n O H - = 0 , 1 m o l
→ aa chỉ có 1 nhóm COOH
![]()
Bảo toàn khối lượng
![]()
→ m a . a = 11,9 + 0,1.18 – 0,05. (40 + 56) = 8,9 (g)
→ M a . a = 8 , 9

Ta có thể viết 2 phản ứng:
Fe+6HNO3 ⇒ Fe(NO3)3 +3NO2 +3H2O
Cu+4HNO3 ⇒ Cu(NO3)2 +2NO2 +2H2O
Có
![]()
Quan sát các phản ứng nhận thấy:
![]()
![]()
Dung dịch A thu được chứa Fe(NO3)3 và Cu(NO3)2.
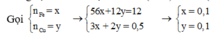
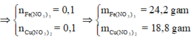
Áp dụng định luật bảo toàn khối lượng ta có:
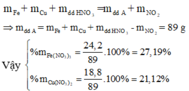
Đáp án B.
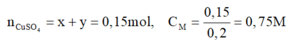
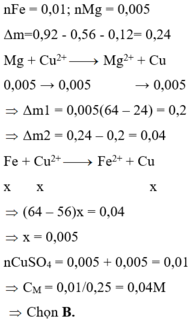


\(n_{CuSO_4}=\dfrac{150.3,2}{100.160}=0,03\left(mol\right)\)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: CuSO4 + Fe --> FeSO4 + Cu
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,03}{1}\) => CuSO4 hết, Fe dư
PTHH: CuSO4 + Fe --> FeSO4 + Cu
______0,03----->0,03--->0,03-->0,03
=> mFeSO4 = 0,03.152 = 4,56(g)
=> mdd = 150 + 0,03.56 - 0,03.64 = 149,76(g)
=> C% = \(\dfrac{4,56}{149,76}.100\%=3,045\%\)