Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vì đồng không tác dụng với HCl loãng :
1) Chất rắn không tan là đồng nên :
\(m_{Al}=11,8-6,4=5,4\left(g\right)\)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Pt : \(2Al+6HCl\rightarrow2AlCl_3+3H_2|\)
2 6 2 3
0,2 0,3
\(n_{H2}=\dfrac{0,2.3}{2}=0,3\left(mol\right)\)
\(V_{H2\left(dktc\right)}=0,3.22,4=6,72\left(l\right)\)
2) Có : \(m_{Cu}=6,4\left(g\right)\)
\(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
Pt : \(2Al+6H_2SO_{4đặc}\underrightarrow{t^o}Al_2\left(SO_4\right)_3+3SO_2+6H_2O|\)
2 6 1 3 6
0,2 0,3
\(Cu+2H_2SO_{4đặc}\underrightarrow{t^o}CuSO_4+SO_2+2H_2O|\)
1 2 1 1 2
0,1 0,1
\(n_{SO2\left(tổng\right)}=0,3+0,1=0,4\left(mol\right)\)
\(V_{SO2\left(dktc\right)}=0,4.22,4=8,96\left(l\right)\)
Chúc bạn học tốt

PTHH: \(2Fe+6H_2SO_{4\left(đ\right)}\rightarrow Fe_2\left(SO_4\right)_3+3O_2\uparrow+6H_2O\)
\(n_{SO_2}=\frac{2,688}{22,4}=0,12mol\) và \(n_{Fe}=\frac{5,04}{56}=0,09mol\)
\(X:Fe_2\left(SO_4\right)_3\)
Theo phương trình \(n_{Fe_2\left(SO_4\right)_3}=\frac{1}{3}n_{SO_2}=0,04mol\)
PTHH: \(Cu+Fe_2\left(SO_4\right)_3\rightarrow2FeSO_4+CuSO_4\)
Theo phương trình \(n_{Fe}=n_{Fe_2\left(SO_4\right)_3}=0,04mol\)
\(\rightarrow m_{Cu}=0,04.64=2,56g\)

\(n_{Cu}=\dfrac{6,4}{64}=0,1\left(mol\right)\)
Pt : \(Cu+2H_2SO_{4đặc,nóng}\rightarrow CuSO_4+SO_2+2H_2O|\)
1 2 1 1 1
0,1 0,1
\(n_{SO2}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(V_{SO2\left(dktc\right)}=0,1.22,4=2,24\left(l\right)\)
Chúc bạn học tốt

\(n_{SO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ PTHH:Cu+2H_2SO_{4\left(đ\right)}\rightarrow CuSO_4+2H_2O+SO_2\uparrow\\ \Rightarrow n_{Cu}=0,1\left(mol\right)\\ \Rightarrow m_{Cu}=0,1\cdot64=6,4\left(g\right)\\ \Rightarrow m_{CuO}=10-6,4=3,6\left(g\right)\)
có thể giải thích cho em cái phần mCuO = 10 - 6,4 được không ạ

\(n_{Cu}=\frac{32}{64}=0,5mol\)
Phương trình hoá học:
\(Cu+2H_2SO_4đ,n\rightarrow CuSO_4+SO_2\uparrow+2H_2O\)
Theo PTTH: \(n_{SO_2}=n_{Cu}=0,5mol\)
\(\rightarrow V_{SO_2}\left(đktc\right)=0,5.22,4=11,2l\)

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right);n_{SO_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
0,2------------------------>0,2
\(2Fe+6H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\)
0,2---------------------------------------->0,3
\(Cu+2H_2SO_{4\left(đ\right)}\xrightarrow[]{t^o}CuSO_4+SO_2+2H_2O\)
0,15<--------------------------------0,15
=> \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,2.56}{0,2.56+0,15.64}.100\%=53,85\%\\\%m_{Cu}=100\%-53,85\%=46,15\%\end{matrix}\right.\)

2 A l + 3 H 2 S O 4 → A l 2 S O 4 3 + 3 H 2
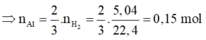
⇒ m F e 2 O 3 (bđ) = 20,05 - 0,15.27 = 16g
⇒ n F e 2 O 3 (bđ) = 16/160 = 0,1 mol
2Al + F e 2 O 3 → A l 2 O 3 + 2Fe
Bđ: 015 0,1
Pư: 0,15 0,065
Dư: 0 0,025
⇒ m F e 2 O 3 (dư) = 0,025.160=4g
⇒ Chọn A.

Theo bảo toàn e + đề bài ta có :
\(3x=0,15.2;2y=0,3\)
Với x, y lần lượt là số mol của Al và Cu)
=> x = 0,1 ; y = 0,15 ; => m = 0,1.27 + 0,15.64 = 12,3
Vì Cu đứng sau H trong dãy hoạt động nên ko đẩy đc H khỏi axit nên Cu ko tác tác dụng với HCl nhưng Al thì có(vậy h2 thoát ra là của Al pư)
nH2=3.36/22.4=0.15mol
PTHH: 2Al + 6HCl ---> 2AlCl3 + 3H2
0.1 0.15
m=n*M=>0.1*27=2.7g (1)
Ta biết Al,Fe,Cr thụ động với h2so4 và HNO3 đặc nguội nên trong X chỉ có Cu pư:
nNO2=V*22.4=>6.72/22.4=0.3 mol
PTHH: Cu +4 HNO3 -> Cu(NO3)2 + 2NO2 + 2H2O
0.15 0.3
mCu=0.15*64=9.6g (2)
Từ (1),(2) =>m X =2.7+9.6=12.3g
OH dear,giải xong mệt quá zzzzzzz, chúc em học tốt

nH2 = 0,13 mol; nSO2 = 0,25 mol
Ta có
2H+ + 2e → H2 Cu → Cu2+ + 2e
0,26 ←0,13 0,12 0,24
S+6 + 2e → S+4
0,5 ← 0,25
TH1: M là kim loại có hóa trị không đổi
=> nCu = (0,5 – 0,26) : 2 = 0,12 mol => mCu = 7,68g
=> mM = 3,12g (loại vì khối lượng của M lớn hơn của Cu)
TH2: M là kim loại có hóa trị thay đổi
Do M không có hóa trị I do đó khi phản ứng với HCl thì M thể hiện hóa trị II
M + 2HCl → MCl2 + H2
0,13 ← 0,13
Do M có hóa trị thay đổi => khi phản ứng với H2SO4 đặc nóng thì M thể hiện hóa trị III
2M + 6H2SO4 → M2(SO4)3 + 3SO2 + 6H2O
0,13 → 0,195
Cu + 2H2SO4 → CuSO4+ SO2 + 2H2O
0,055 ← 0,055
=> mM = 10,8 – 0,055 . 64 = 7,28g
=> MM = 56 => Fe
Ta có số mol của Cu và Fe trong 10,8 g lần lượt là 0,055 và 0,13 mol
=> Trong 5,4g có số mol Cu và Fe lần lượt là 0,0275 và 0,065 mol
nAgNO3 = 0,16mol
Fe + 2AgNO3 → Fe(NO3)2 +2Ag
0,065 0,13 0,065 0,13
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,015 0,03 0,03
=> nCu dư = 0,0275 – 0,015 = 0,0125mol
m = mCu dư + mAg = 0,0125 . 64 + 0,16 . 108 = 18,08g
\(n_{Cu}=\dfrac{6.4}{64}=0.1\left(mol\right)\)
\(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{^{^{t^0}}}CuSO_4+SO_2+2H_2O\)
\(0.1.......................................0.1\)
\(V_{SO_2}=0.1\cdot22.4=2.24\left(l\right)\)