Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Số mol các chất là:
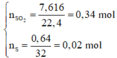
Sơ đồ phản ứng:
Al Zn ⏟ 11 , 9 g a m + H 2 S O 4 ( đ ặ c ) → Al 2 ( SO 4 ) 3 ZnSO 4 ⏟ M u ố i + S O 2 ⏟ 0 , 34 mol S ⏟ 0 , 02 m o l + H 2 o
Áp dụng công thức của bài toán kim loại tác dụng với H2SO4 đặc ta có:

E có 1 chút nhầm lẫn ở câu cuối
Mg + 2HCl ‐> MgCl + H ﴾1﴿ 2Al + 6HCl ‐> 2AlCl + 3H ﴾2﴿ Fe + 2HCl ‐> FeCl + H ﴾3﴿
Theo bài ra ta có : H2 = = 0,4 ﴾mol﴿ Thep ptpu ﴾1﴿﴾2﴿﴾3﴿ ta thấy HCl = H2 = 0,4 .2 = 0,8 ﴾mol﴿ => HCl = 0,8 .36,5 = 26,8 ﴾g﴿ Ap dụng định luật bảo toàn khối lượng : m hỗn hợpMg ,Al,Fe + HCl= m muối MgCl , ALCL , FeCl + H ﴾=﴿ 15+26,8 =m+0,4.2 ﴾=﴿ 41,8 =m +0,8 => m=41,8 -0,8=41﴾g﴿Mg + 2HCl -> MgCl2 + H2 (1)
2Al + 6HCl -> 2AlCl3 + 3H2 (2)
Fe + 2HCl -> FeCl2 + H2 (3)
Theo bài ra ta có : nH2 =\(\frac{8,69}{22,4}\) = 0,4 (mol)
Thep ptpu (1)(2)(3) ta thấy
nHCl = 2nH2 = 0,4 .2 = 0,8 (mol)
=> m HCl = 0,8 .36,5 = 26,8 (g)
Ap dụng định luật bảo toàn khối lượng : m hỗn hợpMg ,Al,Fe +m HCl= m muối MgCl2 , ALCL3, FeCl2 +mH2
(=) 15+26,8 =m+0,4.2
(=) 41,8 =m +0,8
=> m=41,8 =0,8=41(g)

\(n_S = \dfrac{0,64}{32} = 0,02(mol)\)
Gọi \(n_{Cu} = a ; n_{Zn} = b\)
\(\Rightarrow 64a + 65b = 12,9(1)\)
Bảo toàn electron :
\(2n_{Cu} + 2n_{Zn} = 2n_{SO_2} + 6n_S\\ \Rightarrow 2a + 2b = 0,14.2 + 0,02.6(2)\)
Từ (1)(2) suy ra a = 0,1 ; b = 0,1
Vậy : \(\%m_{Cu} = \dfrac{0,1.64}{12,9}.100\% = 49,61\%\)

nSO2 = \(\dfrac{2,8}{22,4}\)=0,125 mol
S+6 + 2e → S+4
0,25<-----0,125
=> Số mol e do 3,35 gam hỗn hợp kim loại nhường là 0,25 mol.
Xét phản ứng với Clo
Kim loại + Cl2 → Muối clorua
Có 3,35 gam kim loại phản ứng nên số mol e kim loại nhường cũng là 0,25 mol
Cl20 + 2e → 2Cl-1
0,25 --> 0,25
=> nCl-1 trong muối clorua = 0,25 mol
<=> mCl-1 = 0,25.35,5 = 8,875 gam.
mMuối = mKim loại + mCl-1 = 3,35 + 8,875 = 12,225 gam.
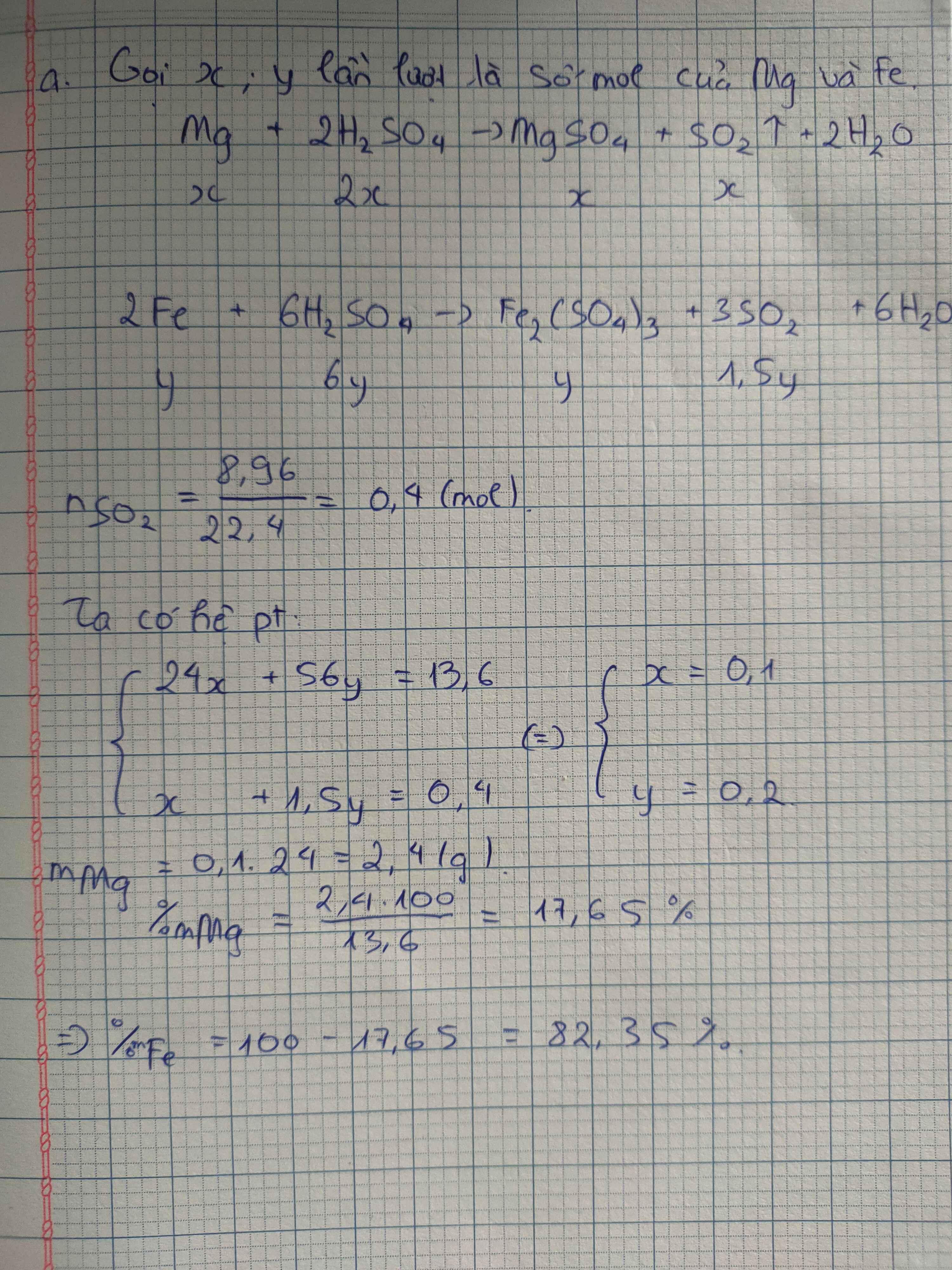

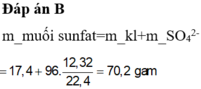
\(H_2SO_4.đặc.nóng?\\ n_S=\dfrac{1,6}{32}=0,05mol\\ BTe:2n_{SO_4^{2-}}=2n_{SO_2}+6n_S\\ < =>2n_{SO_4^{2-}}=2.0,2+6.0,05\\ < =>n_{SO_4^{2-}}=0,35mol\\ m_{muối}=7,5+0,35.96=41,1g\)