Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Đặt nFeO = 2x mol; n F e 3 O 4 = x mol
→nFe = 2x+3x = 5x mol; nO = 2x+ 4x = 6x mol
20 gam hỗn hợp rắn Y có chứa Fe và O
→mO (trong Y) = mY - mFe = 20-5x.56 gam
→mO (đã phản ứng) = mO (X) - mO (Y) = 6x.16- (20-5x.56) = 376x-20 (gam)
→nO (đã phản ứng)= 376 x - 20 16 ( m o l ) = nCO pứ
CO+ m gam X→ 20 gam Y + H2SO4 đặc nóng dư→ Fe2(SO4)3+ SO2
Ta có: n S O 2 = 5,6/22,4 = 0,25 mol
- Quá trình cho e:
C+2 → C+4+ 2e
Fe→ Fe3++ 3e
5x → 15x mol
- Quá trình nhận e:
S+6+ 2e→ SO2
0,5← 0,25 mol
O + 2e →O-2
Bản chất phản ứng khử oxit sắt: CO + O(oxit) → CO2
Áp dụng định luật bảo toàn e: ne cho = ne nhận
→ 2 . 376 x - 20 16 +15x = 0,5+ 6x.2→ x = 0,06 mol
→m = 72.2x+ 232x = 22,56 gam

Đáp án D
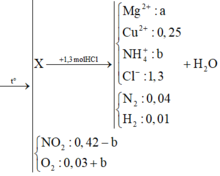
Hỗn hợp gồm: Mg ( a mol) ; Cu(NO3)2 ( 0,25 mol)
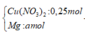
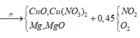
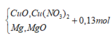
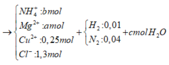
Vì H2 sinh ra nên không còn NO3− trong muối
Bảo toàn điện tích trong dung dịch → 2a + b + 0,25 .2 = 1,3 → 2a + b = 0,8 (1)
Bảo toàn mol H: 1,3 = 4b + 0,01 . 2 + 2c → 4b + 2c = 1,28 (2)
Bảo toàn O:
→ a = 0,39 ; b = 0,02 , c = 0,6
Vậymmuoi = 24.0,39 + 18.0,02 + 64.0,25 + 35,5.1,3 = 71,87 g
→ a = 0,39 ; b = 0,02 , c = 0,6
Vậy mmuoi = 24.0,39 + 18.0,02 + 64.0,25 + 35,5.1,3 = 71,87 gam
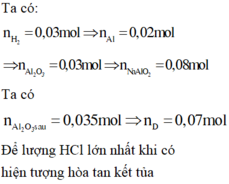
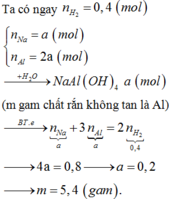

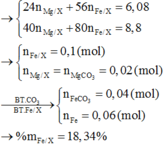
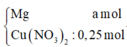
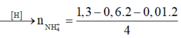
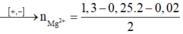
Chọn đáp án B