Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khi tỉ lệ số mol khác nhau, điều kiện phản ứng khác nhau

Ta có: $n_{Al}=n_{Fe}=0,1(mol)$
Sau phản ứng thì Al hết, Fe chưa phản ứng hoặc còn dư
Gọi số mol $Cu(NO_3)_2 và $AgNO_3$ lần lượt là a;b
Ta có: $64a+108b=28$
Bảo toàn e toàn bộ quá trình ta có: $2a+b=0,4$
Giải hệ ta được $a=0,1;b=0,2$
$\Rightarrow [Cu(NO_3)_2]=1M;[AgNO_3]=2M$
\(n_{H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(\Rightarrow n_{Fe\left(dư\right)}=0.05\left(mol\right)\)
\(n_{Al}=n_{Fe}=a\left(mol\right)\)
\(\Rightarrow a=\dfrac{8.3}{27+56}=0.1\)
\(n_{AgNO_3}=x\left(mol\right),n_{Cu\left(NO_3\right)_2}=y\left(mol\right)\)
\(m_{cr}=108x+64y=28\left(1\right)\)
Bảo toàn e :
\(x+2y=0.4\left(2\right)\)
\(\left(1\right),\left(2\right):x=0.2,y=0.1\)
\(C_{M_{AgNO_3}}=\dfrac{0.2}{0.1}=2\left(M\right)\)
\(C_{M_{Cu\left(NO_3\right)_2}}=\dfrac{0.1}{0.1}=1\left(M\right)\)

Đáp án B
(NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3 + 2H2O
FeCl2 + Ba(OH)2 → BaCl2 + Fe(OH)2 ↓
2Cr(NO3)3 + 4Ba(OH)2 → 3Ba(NO3)2 + Ba(CrO2)2 + 4H2O
K2CO3 + Ba(OH)2 → BaCO3 ↓ + 2KOH
2Al(NO3)3 + 4Ba(OH)2 → 3Ba(NO3)2 + Ba(AlO2)2 + 4H2O
Đáp án B.

Đáp án A
Bảo toàn nguyên tố N ta có: 30 = 8.3+3x suy ra x=2
Bảo toàn nguyên tố O ta có: 30.3= 8.3.3+ 3y+15 suy ra y=1
→NxOy là N2O

Đáp án C
(1)Na2CO3+ BaCl2 → BaCO3 + 2NaCl
Ba2+ + CO32-→ BaCO3
(2) (NH4)2CO3+ Ba(NO3)2→ 2NH4NO3 + BaCO3
Ba2+ + CO32-→ BaCO3
(3) Ba(HCO3)2+ K2CO3 → 2KHCO3 + BaCO3
Ba2+ + CO32-→ BaCO3
(4) BaCl2+ MgCO3→ không phản ứng

Phản ứng đầu tiên sai, vì không có N trong sản phẩm cuối, do đó không bảo toàn về nguyên tố.
Chỉ là suy luận của mình thôi nha![]()
Mình nghỉ nên chọn PƯ trên . Vì thường chất chứa trong axit trước PƯ mới tạo thành chất khí. Chỉ khi nào axit là HNO3 mới tạo ra 2 khí là SO2 và NO ( hoặc NO2, N2...) thôi,
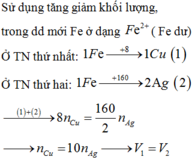
Nếu sản phẩm khí có H2 là NO3- hết, H+ có thể dư hoặc vừa đủ.
Còn H+ dư thì mình phải dựa vào trường hợp tiếp nữa, nếu NO3- dư thì các chất trong dung dịch bị oxi hóa lên mức oxi hóa cao nhất.