Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

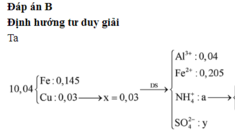
Đáp án B
Sau phản ứng thu được hỗn hợp kim loại gồm Fe, Cu
=>mFe=10,04.80,88/100=8,12 gam; mCu=1,92 gam
=>nFe=0,145 mol; nCu=0,03 mol =>nFe pu=0,35-0,145=0,205 mol; nCu(NO3)2=0,03 mol.
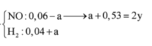
Đặt nNO=x; nH2=y; nNH4+=z (mol).
- Ta có: x+y=n khí=0,1 mol (1).
- BT e: 3nAl+2nFe=3nNO+2nH2+8nNH4++2nCu=>0,04.3+0,205.2=3x+2y+8z+2.0,03 (2)
- BTNT N: nNO3- bđ=nNO+nNH4+=>0,03.2=x+z(3)
Giải (1),(2),(3)=>x=0,03; y=0,07; z=0,03 mol.
Dung dịch muối gồm có: 0,04 mol Al3+; 0,205 mol Fe2+; 0,03 mol NH4+
BT điện tích =>nSO4 2-=(0,04.3+0,205.2+0,03.1)/2=0,28 mol.
=> m muối=0,04.27+0,205.56+0,03.18+0,28.96=39,98 gam.

Đáp án C
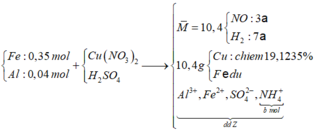
nCu = (10,4. 0,191235 )/64= 0,03 (mol) => nCu(NO3)2 = 0,03
=> nFe dư = ( 10,4 -0,03.64)/56 = 0,145 (mol) => nFe pư = 0,35 – 0,145 = 0,205 (mol)
Hỗn hợp khí có M = 10,4 => Dùng quy tắc đường chéo => nNO = 3a và nH2 = 7a (mol)
Bảo toàn nguyên tố N ta có: nNO + nNH4+ = 2nCu(NO3)2
=> 3a + b = 0,03.2 (1)
Bảo toàn e: 2nFe pư + 3nAl = 3nNO + 2nH2 + 8nNH4+ + 2nCu2+
=> 2.0,205 + 3. 0,04 = 3.3a + 2.7a + 8b + 2. 0,03
=> 23a + 8b = 0,47 (2)
Từ (1) và (2) => a = 0,01 và b = 0,03 (mol)
Bảo toàn điện tích với dung dịch Y gồm Al3+ (0,04 ); Fe2+: (0,205); NH4+ (0,03) và SO42-
=> 3.0,04 + 2.0,205 = 0,03 + 2nSO4
=> nSO4 = 0,28 (mol)
=> mmuối = mAl3+ + mFe2+ + mNH4+ + mSO42-
= 0,04.27 + 0,205.56 + 0,03.18 + 0,28.96
= 39,98 (g)
% Al2(SO4)3 = (0,02. 342) :39,98 ).100% = 17,11% ≈ 17,15%
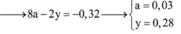


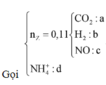
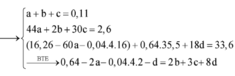
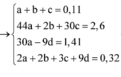
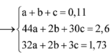
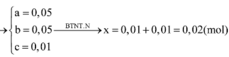

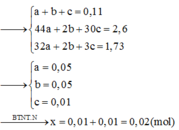


Đáp án B