Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C

- Giả sử Mg, Fe đều phản ứng hết với muối kim loại => Z chứa toàn bộ số mol Mg2+ ; Fex+
=> T chứa Mg(OH)2 và Fe(OH)x => Chất rắn cuối cùng là MgO và Fe2O3 chắc chắn phải có khối lượng lớn hơn lượng kim loại ban đầu trong X => Không thỏa mãn đề bài (7,2 < 7,36)
=> Các muối nitrat phản ứng hết, kim loại dư và đó là Fe (vì Mg phản ứng trước)
=> kết tủa Y gồm Cu, Ag, Fe.
- Gọi nMg = a ; nFe(pứ) = b ; nFe dư = c => mX = 24a + 56b + 56c = 7,36 (1)
- Bảo toàn e cho phản ứng trao đổi muối: 2nMg + 2nFe pứ = nAg + 2nCu = 2a + 2b
- Khi Y + H2SO4 đặc nóng (Fe → Fe3+)
Bảo toàn electron: 2nCu + nAg + 3nFe dư = 2nSO2 = 2.5,04/22,4 = 0,45 mol
=> 2a + 2b + 3c = 0,45 (2)
- Như đã phân tích ở trên. chất rắn cuối cùng gồm MgO và Fe2O3.
Bảo toàn nguyên tố: nMg = nMgO = a ; nFe2O3 = ½ nFe pứ = 0,5b
=> mrắn = mMgO + mFe2O3 = 40a + 160.0,5b = 40a + 80b = 7,2 (3)
Từ (1,2,3) => a = 0,12 ; b = 0,03 ; c = 0,05 mol
=> mFe(X) = 56.(0,03 + 0,05) = 4,48g
=> %mFe(X) = 4,48: 7,36 = 60,87%

Đáp án : A
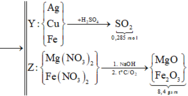
Ta thấy mX > mRắn (gồm oxit) => Y gồm cả Fe , Cu , Ag
Gọi số mol Mg là x ; số mol Fe phản ứng đầu là y và dư sau đó là z mol
=> mX = 24x + 56y + 56z = 7,36g (1)
Bảo toàn e : 2nMg + 2nFe pứ + 3nFe dư = nAg + 2nCu + 3nFe dư = 2nSO2
=> 2x + 2y + 3z = 0,45 mol
,mrắn = mMgO + mFe2O3 = 40x + 80y = 7,2g
=> x = 0,12 mol ; y = 0,03 mol ; z = 0,05 mol
=> %mFe(X) = 60,87%

Đáp án : C
nSO2 = 0,225 mol
Chất rắn sau khi nung chỉ nặng 7,2 gam nên toàn bộ Mg và Fe không thể chuyển hết về oxit được (Lúc đó mrắn > 7,36), tức là trong Y phải có Fe dư —> AgNO3 và Cu(NO3)2 đã hết
Đặt a, b, c là số mol Mg, Fe phản ứng và Fe dư —> 24a + 56(b + c) = 7,36
Chất rắn Y gồm Ag, Cu và Fe dư, phần Ag, Cu do Mg (a) và Fe (b) đẩy ra nên 2a + 2b = nAg + 2nCu
Trong khi đó: nAg + 2nCu + 3nFe dư = 2nSO2 —> 2a + 2b + 3c = 0,225.2
Chất rắn cuối bài gồm MgO (a) và Fe2O3 (b/2) —> 40a + 160b/2 = 7,2
Giải hệ: a = 0,12 mol b = 0,03 mol c = 0,05 mol —> nFe = 0,08 mol —> %mFe = 60,87%

Đáp án D
Quan sát quá trình 1:

BTKL có nH2O = 0,92 mol. Bảo toàn H chứng
tỏ trong X chứa 0,26 mol H+ dư như trên.
♦ Quá trình 2: để ý khí Y có M = 18,8
→ là H2 và NO. Quan sát quá trình chính:
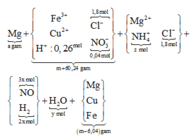
giải tỉ khối Y tìm tỉ lệ 2 khí NO : H2 là 3 : 2 rồi gọi các ẩn như sơ đồ:
• Ghép cụm: nH2O = 2nNO + 3nNH4 ⇄ y = 6x + 3z (1).
• bảo toàn nguyên tố N có: 3x + z = 0,04 mol (2).
• Bảo toàn nguyên tố H có: 4x + 2y + 4z = 0,26 mol (3)
Giải x = 0,01 mol; y = 0,09 mol; z = 0,01 mol ||→ bảo toàn điện tích có nMg2+ = 0,895 mol.
► Chỉ cần BTKL cả sơ đồ có ngay và luôn giá trị yêu cầu a = 21,84 gam

Gọi số mol Mg (x); Fe trong Y là y và Fe trong Z là z
Ta có:
24x + 56y + 56z = 9,2
2x + 3y + 2z = 0,57 ( Bảo toàn e)
40x + 80z = 8,4
⇒ x = 0,15 ; y = 0,07 ; z = 0,03
%Fe = (0,1.56.100)/9,2 = 60,87%
Đáp án D

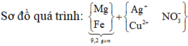

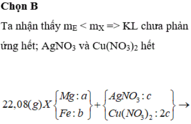
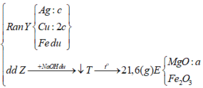
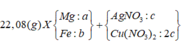
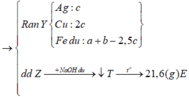
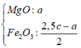
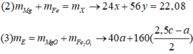
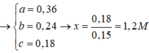
Đáp án : D
Gọi số mol Mg = Fe = x ; số mol Al = y ; số mol Cu = z trong X
=> 80x + 27y + 64z = 7,5g
2 n H 2 = 2nMg + 2nFe + 3nAl
=> 4x + 3y = 0,46 mol
Khi cho 1 lượng vừa đủ Mg(NO3)2 để phản ứng với Cu và Fe2+
tạo khí không màu hóa nâu trong không khí (NO)
=> NO3- chuyển hoàn toàn thành NO
=> bảo toàn e : 2nCu + n F e 2 + = 3nNO = 3 n N O 3
=> n N O 3 = (2z + x)/3 mol
=> n M g N O 3 2 = (x + 2z)/6 (mol)
=> Khi phản ứng với NaOH tạo kết tủa gồm :
x mol Fe(OH)3 ; [x + (x + 2z)/6 ] mol Mg(OH)2 và z mol Cu(OH)2
=> 9,92g = 524x/3 + 352z/3
=> x = 0,04 ; y = 0,1 ; z = 0,025 mol
=>%mFe(X) = 29,87%