Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
Gọi nNa = nBa = x (mol)
nH2SO4 = 0,125 (mol); nCuSO4 = 0,125 (mol) ; nH2 = 0,15 (mol)
Ta thấy: nH2 = 0,15 (mol) > nH2SO4 => Na, Ba phản ứng hết với axit sau đó tiếp tục phản ứng với H2O
Ta có: ∑ ne (KL nhường) = ∑ n e( H2 nhận)
=> x + 2x = 0,15.2
=> x = 0,1 (mol)
=> nOH- = 2 ( nH2 – nH2SO4) = 2 ( 0,15 – 0,125) = 0,05 (mol)
=> nCu(OH)2 = ½ nOH- = 0,025 (mol)
m↓ = mCu(OH)2 + mBaSO4 = 0,025.98 + 0,1.233 = 25,75 (g)
Đáp án A

Đáp án A
Gọi nNa = nBa = x (mol)
nH2SO4 = 0,125 (mol); nCuSO4 = 0,125 (mol) ; nH2 = 0,15 (mol)
Ta thấy: nH2 = 0,15 (mol) > nH2SO4
=> Na, Ba phản ứng hết với axit sau đó tiếp tục phản ứng với H2O
Ta có: ∑ ne (KL nhường) = ∑ n e( H2 nhận)
=> x + 2x = 0,15.2
=> x = 0,1 (mol)
=> nOH- = 2 ( nH2 – nH2SO4) = 2 ( 0,15 – 0,125) = 0,05 (mol)
=> nCu(OH)2 = ½ nOH- = 0,025 (mol)
m↓ = mCu(OH)2 + mBaSO4 = 0,025.98 + 0,1.233 = 25,75 (g)

\(n_{H_2}=0,015\left(mol\right)\)
\(n_{H_2SO_4}=0,0152\left(mol\right)\)
\(n_{CuSO_4}=0,0152\left(mol\right)\)
\(Ba^{2+}+SO_4^{2-}-->BaSO_4\)
\(Cu^{2+}+2OH^--->Cu\left(OH\right)_2\)
a) Do 2 kim loại có cùng số mol \(\Rightarrow\) đặt \(n_{Na}=n_{Ba}=a\left(mol\right)\)
BT e : \(n_{Na}+2n_{Ba}=2n_{H_2}\Leftrightarrow a+2a=0,15.2\Rightarrow a=0,1\left(mol\right)\)
\(n_{Na^+}=n_{Na}=0,1\left(mol\right);n_{Ba^{2+}}=n_{Ba}=0,1\left(mol\right)\)
\(\Sigma n_{SO_4^{2-}}=n_{H_2SO_4}+n_{CuSO_4}=0,0152+0,0152=0,0304\left(mol\right)\)
\(\Rightarrow SO_4^{2-}pư\) hết \(\Rightarrow n_{BaSO_4}=0,0304.233=7,0832\left(g\right)\)
\(\Sigma n_{OH^-}=n_{Na^+}+2n_{Ba^{2+}}=0,1+0,1.2=0,3\left(mol\right)\)
\(n_{OH\left(Cu\left(OH\right)_2\right)}=n_{OH^-Bđ}-n_{Ba^{2+}dư}-n_{Na^+}=0,3-\left(0,1-0,0304\right)-0,1=0,1304\left(mol\right)\)

Đáp án B
nBa = nBa(OH)2 = 0,3 mol
nSO4 = nH2SO4 + nZnSO4 = 0,325 mol
nOH = 0,8 mol ; nH+ = 0,25 mol ; nZn2+ = 0,2 mol
Ba2+ + SO42- → BaSO4
0,3 → 0,3 mol
nOH (pứ Zn2+) = 0,8 – nH+ = 0,55 mol
=> nOH : nZn2+ = 2,75 => Kết tủa hòa tan 1 phần
=> nZn(OH)2 = 2 nZn2+ – 0,5 nOH = 0,125 mol
=> m = 82,275g

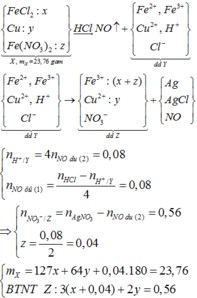
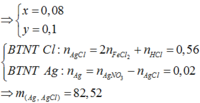
Đáp án A
Gọi nNa = nBa = x (mol)
nH2SO4 = 0,125 (mol); nCuSO4 = 0,125 (mol) ; nH2 = 0,15 (mol)
Ta thấy: nH2 = 0,15 (mol) > nH2SO4 => Na, Ba phản ứng hết với axit sau đó tiếp tục phản ứng với H2O
Ta có: ∑ ne (KL nhường) = ∑ n e( H2 nhận)
=> x + 2x = 0,15.2
=> x = 0,1 (mol)
=> nOH- = 2 ( nH2 – nH2SO4) = 2 ( 0,15 – 0,125) = 0,05 (mol)
=> nCu(OH)2 = ½ nOH- = 0,025 (mol)
m↓ = mCu(OH)2 + mBaSO4 = 0,025.98 + 0,1.233 = 25,75 (g)