Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

+ + NO3– + 3e → NO + 2H2O ⇒ nH+ dư = 4nNO = 0,06 mol.
Bảo toàn nguyên tố Hidro: nH2O = (0,66 - 0,06 - 0,075 × 2) ÷ 2 = 0,225 mol.
Quy hỗn hợp ban đầu về Fe và O ⇒ nO = nH2O = 0,225 mol.
⇒ nFe = (17,04 - 0,225 × 16) ÷ 56 = 0,24 mol. Bảo toàn electron cả quá trình:
3nFe = 2nO + 2nH2 + 3nNO + nAg ⇒ nAg = 0,075 mol.
► Kết tủa gồm 0,075 mol Ag và 0,66 mol AgCl
⇒ m = 0,075 × 108 + 0,66 × 143,5 = 102,81(g)
Đáp án A

Đáp án A
![]()
Sau phản ứng còn lại 0,2m gam chất rắn.
=> kim loại dư ![]()
![]()
Bảo toàn khối lượng: m + 0,4.63 + 0,2.98 = 0,2m + 50 + 0,4.18 + 0,2.30 => m = 23(g)
=> Chọn A

Giải thích: Đáp án A
n Fe = 0.2 mol , n Cu(NO3)2 = 0,2 mol => n NO3- = 0,4 mol
n HCl = n H+ = 0,4 mol
Fe + 4 H+ + NO3-→ Fe3+ + NO + 2 H2O
0,2 0,4 0,4 =>0,1 0,1 mol
=> V NO = 2,24 l
=> n Fe dư = 0,2- 0,1 = 0,1 mol
Fe +2 Fe3+→3 Fe2+
0,1 0,1 0,15 mol
=> n Fe dư = 0,05 mol
Fe + Cu2+ →Fe2++ Cu
0,05 0,2 => 0,05
=> m Cu = 0,05 . 64 = 3,2 g

Giải thích:
Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH Giải phóng khí H2 => X chứa A dư, oxit sắt bị khử hết
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
0,02 ← 0,03 (mol)
nAl(OH)3 = 46,8 : 78 = 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,29 ← ( 0,6 – 0,02)
Z gồm Fe, xét quá trình Z tan trong HNO3
nNO = 0,58 (mol) => nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol)
=> mFe = 146,52 – 1,74.62 = 38,64(g)
=> mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g)
Đáp án D

Đáp án D
Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH giải phóng khí H2 => X chứa A dư, oxit sắt bị khử hết
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
0,02 ← 0,03 (mol)
nAl(OH)3 = 46,8 : 78 = 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,29 ← ( 0,6 – 0,02)
Z gồm Fe, xét quá trình Z tan trong HNO3
nNO = 0,58 (mol) => nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol)
=> mFe = 146,52 – 1,74.62 = 38,64(g)
=> mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g)

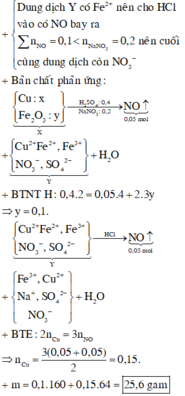
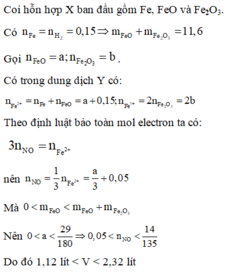
Đáp án D