Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Thí nghiệm 1:
Khí sinh ra làm mất màu dung dịch bromine/thuốc tím.

CH2=CH2 + Br2 → CH2Br–CH2Br
3CH2=CH2 + 4H2O + 2KMnO4 → 3HO–CH2–CH2–OH + 2MnO2 + 2KOH

- Hiện tượng: khí sinh ra làm mất màu nước bromine, thuốc tím, khi đốt cháy tỏa ra nhiều nhiệt.
- Giải thích hiện tượng: Khí ethylene sinh ra từ phản ứng tách nước ethanol (xúc tác sulfuric acid đặc), ethylene phản ứng với dung dịch bromine và dung dịch thuốc tím, làm mất màu hai dung dịch trên. Khi đốt cháy khí ethylene, phản ứng tỏa ra nhiều nhiệt.
- Phương trình hóa học:


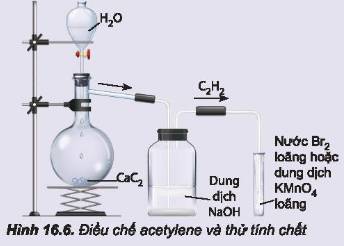
- Hiện tượng: Đất đèn (thành phần chính CaC2) tác dụng với nước sinh ra khí acetylene (C2H2). Dẫn acetylene vào các ống nghiệm chứa dung dịch KMnO4 và nước Br2 thấy các dung dịch này nhạt dần đến mất màu do liên kết pi ở acetylene kém bền vững.
- Khi đốt acetylene cháy, toả nhiều nhiệt.
- Phương trình hoá học minh hoạ:
CaC2 + 2H2O → Ca(OH)2 + C2H2
CH ≡ CH + 2Br2 → CHBr2 – CHBr2
3CH ≡ CH + 8KMnO4 → 3KOOC – COOK + 8MnO2 + 2KOH + 2H2O
C2H2+\(\dfrac{5}{2}\)O2 →\(nhiet do\) 2CO2+H2O

Hiện tượng:
Sau khoảng 2 phút, thấy ống nghiệm B có màu đậm hơn so với ống nghiệm A.
Kết quả thảo luận:
Khi nhiệt độ tăng lên, cân bằng chuyển dịch theo chiều thuận.

1: Vì brom ko phản ứng với nước ở điều kiện thường nên brom nằm ở lớp dưới
2: Đó là chất AgBr. Phải trung hòa là để tránh xảy ra phản ứng tạo kết tủa giữa \(AgNO_3\) và NaOH
3: Sản phẩm sẽ là AgBr và CH3CH2NO3
\(CH_3CH_2Br+AgNO_3\rightarrow CH_3CH_2NO_3+AgBr\downarrow\)

Đáp án C
Các mệnh đề dúng là: 1, 2, 3, 4
+ Nhỏ dung dịch Br2 vào ống nghiệm chứa benzen không có hiện tượng.
+ Nhỏ nước vào anilin dung dịch không đồng nhất do anilin ít tan trong nước

Đáp án C
Các mệnh đề dúng là: 1, 2, 3, 4
+ Nhỏ dung dịch Br2 vào ống nghiệm chứa benzen không có hiện tượng.
+ Nhỏ nước vào anilin dung dịch không đồng nhất do anilin ít tan trong nước

Ống nghiệm (1) vẫn giữ nguyên màu tím → benzene không phản ứng với KMnO4.
Ống nghiệm (2) màu tím nhạt dần và mất màu → toluene phản ứng với KMnO4.
C6H5CH3 + 2KMnO4 → C6H5COOK+ 2MnO2 + H2O + KOH

Tham khảo:
a) Hexane không phản ứng với dung dịch KMnO4 ở điều kiện thường. Do ở phân tử hexane chỉ có các liên kết đơn C – C và C – H, đó là các liên kết σ bền vững, vì thế hexane tương đối trơ về mặt hoá học, không phản ứng với chất oxi hoá mạnh như KMnO4.
b) Đốt cháy hexane trong bát sứ mà không nên đốt trong cốc thuỷ tinh do phản ứng này toả ra lượng nhiệt lớn có thể làm vỡ cốc thuỷ tinh.
- Phương trình hoá học minh hoạ:
C6H14+\(\dfrac{19}{2}\)O2\(^{ }\underrightarrow{t^o}\)6CO2+7H2O
c) Đốt cháy hexane trong điều kiện thiếu oxygen:
C6H14+\(\dfrac{13}{2}\)O2\(\underrightarrow{t^o}\)6CO+7H2O



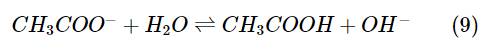
Thí nghiệm 2:
Khí sinh ra làm mất màu dung dịch bromine/thuốc tím.
CaC2 + H2O → C2H2 + Ca(OH)2
CH≡CH + Br2 → CHBr=CHBr
CHBr=CHBr + Br2 → CHBr2-CHBr2
CH≡CH + KMnO4 + H2O → (COOH)2 + MnO2 + KOH