

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



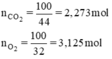
Thể tích của hỗn hợp khí ở 20°C và 1atm
Vhh = 24.(nO2 + nCO2) = 24.(3,125 + 2,273) = 129,552 l.

nO2 = 100/32 = 3,125ml;
nCO2 = 100/44 = 2,273ml;
Vhh khí ở 20oC và 1atm là: 24.(3,125 + 2,273) = 129,552l.

Biết \(m_{\text{O2}}=100g\Rightarrow M_{\text{O2}}=32\frac{g}{mol}\)
Và : \(m_{C\text{O2}}=100g\Rightarrow M_{C\text{O2}}=44\frac{g}{mol}\)
\(n_{\text{O2}}=\frac{m_{\text{O2}}}{M_{\text{O2}}}=\frac{100}{32}=3,125\left(mol\right)\)
\(n_{C\text{O2}}=\frac{m_{C\text{O2}}}{M_{C\text{O2}}}=\frac{100}{44}=2,273\left(mol\right)\)
\(\Rightarrow V=24\left(3,125+2,273\right)=129,552\left(l\right)\)

Ta có :
\(n_{O_2} = \dfrac{3,2}{32} = 0,1(mol)\\ n_{CO_2} = \dfrac{4,4}{44} = 0,1(mol\\\)
Suy ra :
\(n_{hỗn\ hợp\ khí} = 0,1 + 0,1 = 0,2(mol)\\ \Rightarrow V_{hh\ khí} = 0,2.22,4 = 4,48(lít)\)
Ta có: nCO2=\(\dfrac{4,4}{44}\)=0,1 mol
nO2=\(\dfrac{3,2}{32}\)=0,1 mol
Vậy: Vhỗn hợp=24x(0,1+0,1)=4,8 l

a,
2H2+ O2 (t*)-> 2H2O
CH4+ 2O2 (t*)-> CO2+ 2H2O
M X= 0,325.32= 10,4
nX= 11,2/22,4= 0,5 mol
Gọi x là nH2, y là nCH4
Ta có 2x+16yx+y=10,42x+16yx+y=10,4
<=> 8,4x= 5,6y
<=> xy=5,68,4=23xy=5,68,4=23
Vậy nếu mol H2 là 2x thì mol CH4 là 3x
=> 2x+ 3x= 0,5 <=> x= 0,1
=> nH2= 0,2 mol; nCH4= 0,3 mol
%H2= 0,2.1000,50,2.1000,5= 40%
%CH4= 60%
b,
nO2= 28,8/32= 0,9 mol
Spu đốt H2, tạo ra 0,2 mol H2O; đã dùng 0,1 mol O2
Spu đôts CH4, tạo ra 0,3 mol CO2; 0,6 mol H2O; đã dùng 0,6 mol O2
=> Dư 0,2 mol O2
Sau khi ngưng tụ nước còn lại hh khí gồm 0,3 mol CO2; 0,2 mol O2
%V CO2= 0,3.1000,3+0,20,3.1000,3+0,2= 60%
%V O2= 40%
mCO2= 0,3.44= 13,2g
mO2= 0,2.32= 6,4g
%m CO2= 13,2.1006,4+13,213,2.1006,4+13,2= 67,3%
%m O2= 32,7%