Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
∑ nH+ = 2nH2SO4 + nHCl = 2. 0,1.0,05 + 0,1.0,1 = 0,02 (mol)
∑ nOH- = nNaOH + 2nBa(OH)2 = 0,1.0,2 + 2. 0,1.0,1 = 0,04 (mol)
H+ + OH- → H2O
0,02 → 0,02
=> nOH- dư = 0,04 – 0,02 = 0,02 (mol)
=> [OH-] = n: V = 0,02 : 0,2 = 0,01 M
pH = 14 + log(OH-) = 14 + (-1) = 13
Chú ý:
pH được tính theo giá trị của log[H+] chứ không phải log [OH-]

`100mL=0,1L`
`n_{H^+}=0,1.0,05.2+0,1.0,1=0,02(mol)`
`n_{SO_4^{2-}}=0,1.0,05=0,005(mol)`
`n_{OH^-}=0,1.0,2+0,1.0,1.2=0,04(mol)`
`n_{Ba^{2+}}=0,1.0,1=0,01(mol)`
`Ba^{2+}+SO_4^{2-}->BaSO_4`
Do `0,01>0,005->` Tính theo `SO_4^{2-}`
`n_{BaSO_4}=n_{SO_4^{2-}}=0,005(mol)`
`->m_↓=0,005.233=1,165(g)`
`H^{+}+OH^{-}->H_2O`
Do `0,02<0,04->OH^-` dư
`n_{OH^{-}\ pu}=n_{H^+}=0,02(mol)`
`->n_{OH^{-}\ du}=0,04-0,02=0,02(mol)`
Trong X: `[OH^-]={0,02}/{0,1+0,1}=0,1M`
`->pH=14-pOH=14+lg[OH^-]=13`

\(n_{OH^-}=6.10^{-3}\left(mol\right)\)
\(n_{H^+}=V.10^{-4}\left(mol\right)\)
\(n_{OH^-dư}=0,02.\left(0,0001.V+0,06\right)\left(mol\right)\)
Ta có:
\(n_{OH^-dư}+n_{H^+}=n_{OH^-\text{}}\)
\(\Leftrightarrow0,02.\left(0,0001.V+0,06\right)+V.10^{^{-4}}=6.10^{-3}\)
\(\Leftrightarrow V=47,06\left(ml\right)\)

Đáp án B
nCO2 = 0,07; nNaOH = 0,08; nBaCl2 = 0,04; nBa(OH)2 = 0,25a; nBaCO3 = 0,02 = 0,08 + 0,5a
Ba2+ + CO32- → BaCO3↓
0,02 ← 0,02 ← 0,02
CO2 + 2OH-→ CO32- + H2O
0,02 ← 0,04 ← 0,02
CO2còn dư + OH- → HCO3-
0,05 → 0,05
= 0,08 + 0,5a = 0,04 + 0,05 a = 0,02
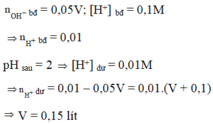
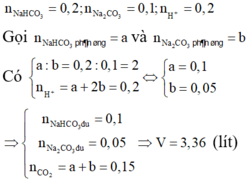
Đáp án A