Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Mg2++ 2OH- → Mg(OH)2
0,045 0,09 0,045 mol
Cu2++ 2OH- → Cu(OH)2
0,06 0,12 0,06 mol
Fe3++ 3OH- → Fe(OH)3
0,03 0,09 0,03 mol
nOH-= 0,09+0,12+0,09=0,3 mol= nNaOH suy ra Vdd= 0,3/2=0,15 lít
mkết tủa= 0,045.58+ 0,06.98+ 0,03.107=11,7 gam

Chọn đáp án B
Có 0,2.(0,15 + 0,1.2) = 0,07 mol nitrat trong suốt quá trình phản ứng, và như thế theo tiêu chí kim loại càng mạnh càng sót lại trước tiên thì dung dịch Y chỉ còn ion của kẽm khi lượng được đưa vào X lên tới 3,25/65 = 0,05 mol nên có 0,035 mol Zn2+ trong Y.
Bảo toàn khối lượng phần kim loại
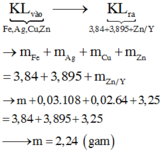

Đáp án C
nNa2SO4= 0,15 mol; nMgSO4= 0,1 mol; nFe2(SO4)3=0,05 mol; nSO4(2-)=0,4 mol
Ba2+ + SO42-→ BaSO4
nBaSO4= nSO4(2-)= 0,4 mol; mBaSO4= 93,2 gam

Đáp án B
• m gam Na + 0,02 mol Al2(SO4)3 → 0,01 mol ↓
• TH1: NaOH hết
2Na + 2H2O → 2NaOH + H2↑
6NaOH + Al2(SO4)3 → 2Al(OH)3↓ + 3Na2SO4
nNa = nNaOH = 0,01 × 3 = 0,03 mol
→ mNa = 0,03 × 23 = 0,69 gam.
• TH2: NaOH dư
2Na + 2H2O → 2NaOH + H2↑ (*)
6NaOH + Al2(SO4)3 → 2Al(OH)3↓ + 3Na2SO4 (**)
NaOH + Al(OH)3 → NaAlO2 + 2H2O (***)
Theo (**) nNaOH = 0,02 × 6 = 0,12 mol; nAl(OH)3 = 0,02 × 2 = 0,04 mol.
Theo (***) nAl(OH)3 phản ứng = 0,04 - 0,01 = 0,03 mol
→ nNaOH = 0,03 mol
→ ∑nNaOH = 0,03 + 0,12 = 0,15 mol → nNa = 0,15 mol
→ mNa = 0,15 × 23 = 3,45 gam

Đáp án B
Hướng dẫn giải:
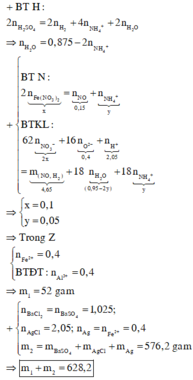
Ta có : nAlCl3= 0,15 mol ; nCuCl2= 0,1 mol ; nFeCl2= 0,15 mol
AlCl3+ 3NH3+ 3H2O → Al(OH)3+ 3NH4Cl
FeCl2+ 2NH3+ 2H2O → Fe(OH)2+ 2NH4Cl
CuCl2+ 4NH3 → [Cu(NH3)4]Cl2
Kết tủa A có Al(OH)3: 0,15 mol và Fe(OH)2: 0,15 mol
2Al(OH)3 → Al2O3+ 3H2O
2Fe(OH)2 +1/2 O2 → Fe2O3+2 H2O
Ta có m gam chất rắn chứa 0,075 mol Al2O3 và 0,075 mol Fe2O3
→ m= 0,075.102+ 0,075.160= 19,65 (gam)


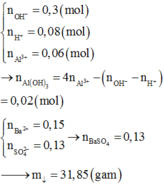
Đáp án A
Hướng dẫn giải:
Al(NO3)3+ 3NH3+ 3H2O → Al(OH)3+ 3NH4NO3
Zn(NO3)2+ 4NH3 → [Zn(NH3)4] (NO3)2
AgNO3+ 2NH3 → [Ag(NH3)2] NO3
Sau phản ứng m gam kết tủa có Al(OH)3
Ta có nAl(OH)3= nAl(NO3)3= 0,1.0,1= 0,01 mol → mAl(OH)3= 0,01.78= 0,78 gam