Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi nZn = a (mol); nFe = b (mol)
=> 65a + 56b = 29,8 (1)
VO2 = 6,72/22,4 = 0,3 (mol)
PTHH:
2Zn + O2 -> (t°) 2ZnO
a ---> 0,5a ---> a
3Fe + 2O2 -> (t°) Fe3O4
b ---> 2b/3 ---> b/3
=> 0,5a + 2b/3 = 0,3 (2)
Từ (1)(2) => a = 0,2 (mol); b = 0,3 (mol)
=> mZn = 0,2 . 65 = 13 (g)
=> mFe = 0,3 . 56 = 16,8 (g)
PTHH:
Zn + 2HCl -> ZnCl2 + H2
0,2 ---> 0,4
Fe + 2HCl -> FeCl2 + H2
0,3 ---> 0,6
=> mHCl = (0,6 + 0,4) . 36,5 = 36,5 (g)
=> mddHCl = 36,5/3,65% = 1000 (g)
Số mol khí oxi cần dùng là 6,72/22,4=0,3 (mol).
BTKL: 65nZn+56nFe=29,8 (1).
BTe: 2nZn+(8/3)nFe=2nO \(\Leftrightarrow\) 6nZn+8nFe=3,6 (2).
Giải hệ phương trình gồm (1) và (2), ta suy ra nZn=0,2 (mol) và nFe=0,3 (mol).
Phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu:
%mZn=0,2.65/29,8\(\approx\)43,62% \(\Rightarrow\) %mFe\(\approx\)100%-43,62%\(\approx\)56,38%.
Số mol HCl cần dùng để hòa tan hồn hợp ban đầu là:
nHCl=2nZn+2nFe=2.0,2+2.0,3=1 (mol).
Khối lượng dung dịch HCl cần dùng là:
m=1.36,5/3,65%=1000 (g).

a) Gọi số mol Mg, Fe là a, b (mol)
=> 24a + 56b = 11,84
\(n_{HCl}=\dfrac{146.14\%}{36,5}=0,56\left(mol\right)\)
PTHH: Mg + 2HCl --> MgCl2 + H2
a--->2a--------->a----->a
Fe + 2HCl --> FeCl2 + H2
b-->2b-------->b------>b
=> 2a + 2b = 0,56
=> a = 0,12; b = 0,16
=> \(\left\{{}\begin{matrix}\%Mg=\dfrac{0,12.24}{11,84}.100\%=24,324\%\\\%Fe=\dfrac{0,16.56}{11,84}.100\%=75,676\%\end{matrix}\right.\)
b) \(n_{H_2}=a+b=0,28\left(mol\right)\)
=> \(V_{H_2}=0,28.22,4=6,272\left(l\right)\)
c) mdd sau pư = 11,84 + 146 - 0,28.2 = 157,28 (g)
=> \(\left\{{}\begin{matrix}C\%_{MgCl_2}=\dfrac{0,12.95}{157,28}.100\%=7,25\%\\C\%_{FeCl_2}=\dfrac{0,16.127}{157,28}.100\%=12,92\%\end{matrix}\right.\)

Gọi số mol Zn, Al là a, b (mol)
=> 65a + 27b = 18,4 (1)
\(n_{O_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
b-->0,75b
2Zn + O2 --to--> 2ZnO
a-->0,5a
=> 0,5a + 0,75b = 0,25 (2)
(1)(2) => a = 0,2 (mol); b = 0,2 (mol)
=> \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{0,2.65}{18,4}.100\%=70,65\%\\\%m_{Al}=\dfrac{0,2.27}{18,4}.100\%=29,35\%\end{matrix}\right.\)
\(2Zn+O_2\rightarrow 2ZnO \)
\(4Al+3O_2\rightarrow 2Al_2O_3 \)
\(n_{O_2}=\dfrac{5,6}{22,4}=0,25(mol) \)
\(Theo PT : x = 0,2 mol ; y = 0,2 mol \)
\(\%\)\(m_{Zn}=\dfrac{0,2.65}{18,4}.100\)\(\%\)\(=70,65 \)\(\%\)
\(\%\)\(m_{Al}=100\)\(\%\)\(-70,65=29,35\)\(\%\)

\(n_{O_2}=\dfrac{2,24}{22,4}=0,1mol\)
Gọi \(\left\{{}\begin{matrix}n_{Zn}=x\\n_{Mg}=y\end{matrix}\right.\)
\(2Zn+O_2\rightarrow\left(t^o\right)2ZnO\)
x 1/2x ( mol )
\(2Mg+O_2\rightarrow\left(t^o\right)2MgO\)
y 1/2y ( mol )
Ta có:
\(\left\{{}\begin{matrix}65x+24y=8,9\\\dfrac{1}{2}x+\dfrac{1}{2}y=0,1\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(\Rightarrow m_{Zn}=0,1.65=6,5g\)
\(\Rightarrow m_{Mg}=0,1.24=2,4g\)

\(a,n_{H_2}=\dfrac{2,576}{22,4}=0,115\left(mol\right)\\ Đặt:n_{Mg}=a\left(mol\right);n_{Al}=b\left(mol\right)\left(a,b>0\right)\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ \Rightarrow\left\{{}\begin{matrix}95a+133,5b=10,475\\a+1,5b=0,115\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,04\\b=0,05\end{matrix}\right.\\ \%m_{Mg}=\dfrac{0,04.24}{0,04.24+0,05.27}.100\approx41,558\%\Rightarrow\%m_{Al}\approx58,442\%\\ b,n_{HCl}=2.n_{H_2}=2.0,115=0,23\left(mol\right)\\ \Rightarrow x=C\%_{ddHCl}=\dfrac{0,23.36,5}{100}.100=8,395\%\)

Có \(\left\{{}\begin{matrix}71.n_{Cl_2}+32.n_{O_2}=11,9\\n_{Cl_2}+n_{O_2}=\dfrac{5,6}{22,4}=0,25\end{matrix}\right.=>\left\{{}\begin{matrix}n_{Cl_2}=0,1\\n_{O_2}=0,15\end{matrix}\right.\)
Gọi số mol Zn, Al là a, b
=> 65a + 27b = 11,9
Al0-3e-->Al+3
b->3b
Zn0-2e-->Zn+2
a-->2a
Cl20 +2e--> 2Cl-
0,1->0,2
O20 +4e--> 2O-2
0,15->0,6
Bảo toàn e: 2a + 3b = 0,8
=> a = 0,1 ; b = 0,2
=> mAl = 0,2.27 = 5,4 (g)

Chọn đáp án C
n H C l = 2 n O o x i t = 2 3 , 33 - 2 , 13 16 = 0,15 (mol)
→ V d d H C l = 0 , 15 0 , 2 = 0,075 (lít)
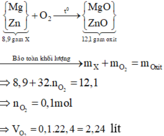
ta có :
2Mg+O2-to>2MgO
x--------0,5x
2Zn+O2-to>2ZnO
y-------0,5y
=>\(\left\{{}\begin{matrix}24x+65y=14,58\\0,5x+0,5y=0,15\end{matrix}\right.\)
=>x=0,12 mol ,y=0,18 mol
=>%mMg=\(\dfrac{0,12.24}{14,58}100\)=19,753%
=>%mZn=80,247%
\(n_{O_2}=\dfrac{4,8}{32}=0,15mol\)
Gọi \(\left\{{}\begin{matrix}n_{Mg}=x\\n_{Zn}=y\end{matrix}\right.\)
\(2Mg+O_2\rightarrow\left(t^o\right)2MgO\)
x 1/2 x ( mol )
\(2Zn+O_2\rightarrow\left(t^o\right)2ZnO\)
y 1/2 y ( mol )
Ta có:
\(\left\{{}\begin{matrix}24x+65y=14,58\\\dfrac{1}{2}x+\dfrac{1}{2}y=0,15\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,12\\y=0,18\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{Mg}=0,12.24=2,88g\\m_{Zn}=0,18.65=11,7g\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{2,88}{14,58}.100=19,75\%\\\%m_{Zn}=100\%-19,75\%=80,25\%\end{matrix}\right.\)