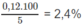Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

P b ( N O 3 ) + N a 2 S O 4 → P b S O 4 ↓ + 2 N a N O 3 A
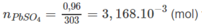
tạo thành trong 500 ml = Số mol P b ( N O 3 ) trong 500 ml.
Lượng P b S O 4 hay P b 2 + có trong 1 lít nước :
3,168. 10 - 3 .2 = 6,336. 10 - 3 (mol).
Số gam chì có trong 1 lít:
6,336.10-3.207 = 1,312 (g/l) hay 1,312 mg/ml.
Vậy nước này bị nhiễm độc chì.

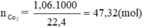
C + O2 → CO2
47,32 ← 47,32 (mol)
Theo pt: nC = nCO2 = 47,32 mol ⇒ mC = 47,32. 12 = 567,84 g
% khối lượng của C là:


C + O2 \(\xrightarrow[]{t^o}\) CO2
nCO2 = \(\dfrac{1,06}{22,4}\approx0,047mol\)
Theo pt: nC = nCO2 = 0,047 mol
=> mC = 0,047.12 = 0,564g
%mC = \(\dfrac{0,564}{0,6}.100\%=94\%44\)

C + O2 => CO2
1,06m3 = 1060 (l) => nCO2 = \(\frac{1060}{22,4}=47,32mol\)
nC = nCO2 = 47,32 mol
=> mC = 47,32.12 = 567,84 (g)
m than đá = 0,6kg = 600g
=> % C = \(\frac{567,84}{600}.100\%\) = 94,64%
C + O2 CO2
1,00mol 1,00mol
47,3 mol = 47,3 (mol)
Phần trăm khối lượng của C trong mẫu than đá: = 94,6%

Số mol ankin: 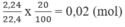
R - C ≡ C H + A g N O 3 + N H 3 → R - C ≡ C - A g ↓ + N H 4 N O 3
0,02 mol 0,02 mol
Khối lượng 1 mol
R
-
C
≡
C
-
A
g
là: 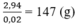
R - C ≡ C - A g = 147 ⇒ R = 147 - 24 - 108 = 15
R là C H 3 ; ankin là C H 3 - C ≡ C H (propin)
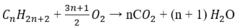
C O 2 + C a ( O H ) 2 → C a C O 3 ↓ + H 2 O
Số mol ankan là 0,08 mol
Số mol C O 2 = số mol C a ( O H ) 2 = 0,16 (mol)
Suy ra 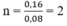
Vậy ankan là C 2 H 6
Khối lượng hỗn hợp A là: 0,02 x 40 + 0,08 x 30 = 3,2 (g)
Về khối lượng,
C
3
H
4
chiếm 
và C 2 H 6 chiếm 75%.

Số mol
O
2
: 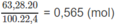
Số mol C O 2 = số mol C a C O 3 = 0,36 (mol).
1. Trong 0,36 mol C O 2 , khối lượng cacbon: 0,36 x 12 = 4,32 (g) và khối lượng oxi: 0,36 x 32 = 11,52 (g).
Khối lượng oxi trong nước là: 0,565 x 32,0 - 11,52 = 6,56 (g).
Khối lương hiđro (trong nước): 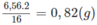
Khối lượng M = khối lượng C + khối lượng H = 4,32 + 0,82 = 5,14 (g)
2. Khi đốt 1 mol ankan, số mol H 2 O tạo ra nhiều hơn số mol C O 2 là 1 mol. Khi đốt hỗn hợp M, số mol H 2 O nhiều hơn số mol C O 2 :
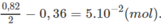
Vậy hỗn hợp M có 5. 10 - 2 mol ankan.
Khối lượng trung bình của 1 mol ankan:
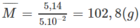
14n + 2 < 102,8 < 14n + 30
⇒ 5,20 < n < 7,20
Đến đây có thể tìm được công thức phân tử và phần trăm khối lượng từng chất như ở cách thứ nhất.

Đáp án B
Ta có: n C a C O 3 l ầ n 1 = 5/100 = 0,05 mol;
n C a C O 3 l ầ n 2 = 2,5/100 = 0,025 mol
Do khi lọc kết tủa rồi đem đun nóng nước lọc thấy xuất hiện kết tủa nên CO2 phản ứng với nước vôi trong theo 2 PTHH sau:
CO2+ Ca(OH)2 → CaCO3+ H2O
0,05← 0,05 mol
2CO2 + Ca(OH)2 → Ca(HCO3)2
0,05← 0,025 mol
Ca(HCO3)2 → t 0 CaCO3+ CO2+ H2O
0,025 → 0,025 mol
→Tổng số mol CO2 ban đầu là:
n C O 2 = 0,05 + 0,05 = 0,1 mol→ V C O 2 = 2,24 lít



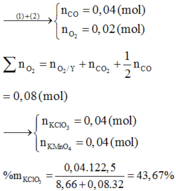
Khi đốt mẫu gang trong oxi, cacbon cháy tạo thành C O 2 . Dẫn C O 2 qua nước vôi trong dư, toàn bộ lượng C O 2 chuyển thành kết tủa C a C O 3 .
C + O 2 → t ° C O 2 (1)
C O 2 + C a ( O H ) 2 → C a C O 3 ↑ + H 2 O (2)
Theo các phản ứng (1) và (2): n c = n C O 2 = n C a C O 3 = 0,01 (mol)
Khối lượng cacbon: m C = 0,01.12 = 0,12 (g)
Hàm lượng (%) cacbon trong mẫu gang:
%C =