Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B.
Hai chất tan là Na2SO4 (0,05 mol) và Al2(SO4)3 (0,05 mol)
Þ Dung dịch X chứa CuSO4: 0,2 mol và NaCl: 0,1 mol
Tại catot có Cu (0,2 mol) và H2 (a mol) và tại anot có Cl2 (0,05 mol) và O2 (b mol)![]()
và mdd giảm = 0,2.64 + 2a + 0,05.71 + 32b = 20,55
Þ a = 0,1 và b = 0,125. Vậy t = 6h

Đáp án C
Nhận xét được lượng chất rắn > bột Fe nên sau phản ứng điện phân thì AgNO3 còn dư và chất rắn này
cũng có thể gồm Fe dư ( nếu không dư thì trong quá trình tính toán số mol nó = 0 thôi ).
Cả quá trình: điện phân: 2AgNO3 + H2O → 2Ag + 2HNO3 + ½.O2↑ .
Sau đó: 3Fe + 8HNO3 → 3Fe(NO3)2 + 2NO↑ + 4.H2O. || Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓.
Quan trọng tiếp theo là chọn ẩn sao cho tính toán nhanh:
gọi số mol AgNO3 bị điện phân là x mol, số mol sắt bị hoà tan là y mol thì ta có:
Khối lượng chất rắn: 14,5 = ( 0,225 - y) × 56 + (0,15 - x ) × 108 → 108x + 56y = 14,3 gam.
Số mol sắt phản ứng: y = (0,15 - x ) ÷ 2 + 3x ÷ 8 → x ÷ 8 + y = 0,075 mol.
Vậy thời gian điện phân t = 96500 × 0,1 ÷ 2,68 = 3600 s = 1h → chọn C.

Chọn đáp án C
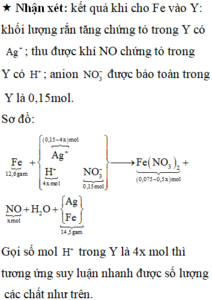
« Nhận xét: kết quả khi cho Fe vào Y: khối lượng rắn tăng chứng tỏ trong Y có Ag+; thu được khí NO chứng tỏ trong Y có H+; anion NO3- được bảo toàn trong Y là 0,15mol.
Gọi số mol H+ trong Y là 4x mol thì tương ứng suy luận nhanh được số lượng các chất như trên.
Bảo toàn khối lượng nguyên tố kim loại 2 vế sơ đồ:
12,6 + (0,15 – 4x) x108 =(0,075 – 1/2x)x 56 + 14,5
Giải phương trình được x = 0,045 mol → ∑ne điện phân trao đổi = 4x = 0,1mol.
Áp dụng định luật Faraday ta có thời gian điện phân t = 96500 x 0,1 : 2,68 = 3600 giây ↔ 1 giờ

Đáp án C
Nhận xét được lượng chất rắn > bột Fe nên sau phản ứng điện phân thì AgNO3 còn dư và chất rắn này
cũng có thể gồm Fe dư ( nếu không dư thì trong quá trình tính toán số mol nó = 0 thôi ).
Cả quá trình: điện phân: 2AgNO3 + H2O → 2Ag + 2HNO3 + ½.O2↑ .
Sau đó: 3Fe + 8HNO3 → 3Fe(NO3)2 + 2NO↑ + 4.H2O.
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓.
Quan trọng tiếp theo là chọn ẩn sao cho tính toán nhanh:
gọi số mol AgNO3 bị điện phân là x mol, số mol sắt bị hoà tan là y mol thì ta có:
Khối lượng chất rắn: 14,5 = ( 0,225 - y) × 56 + (0,15 - x ) × 108 → 108x + 56y = 14,3 gam.
Số mol sắt phản ứng: y = (0,15 - x ) ÷ 2 + 3x ÷ 8 → x ÷ 8 + y = 0,075 mol.
Vậy thời gian điện phân t = 96500 × 0,1 ÷ 2,68 = 3600 s = 1h → chọn C

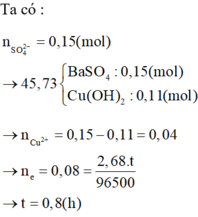



Đáp án B
+ n CuSO 4 = 0 , 3 . 0 , 5 = 0 , 15 ⇒ n BaSO 4 = n SO 4 2 - = 0 , 15 . 233 = 34 , 95 ⇒ n Cu 2 + dư = n Cu ( OH ) 2 = 45 , 73 - 34 , 95 98 = 0 , 11 ⇒ n Cu 2 + bị khử = 0 , 04 . + BTE : 2 n Cu 2 + bị khử = It F ⇒ 2 , 68 t 96500 = 0 , 08 ⇒ t = 2880 giây = 0 , 8 giờ