Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
► Xét phản ứng điện phân: 4AgNO3 + 2H2O → 4Ag↓ + O2↑ + 4HNO3.
Đặt nO2 = x ⇒ nAg = 4x ⇒ mdung dịch giảm = 108 × 4x + 32x = 9,28(g)
||⇒ x = 0,02 mol ⇒ Dung dịch X chứa AgNO3 và HNO3 đều 0,08 mol.
► Xét phản ứng Fe + dung dịch X: nFe = 0,05 mol. Ta có:
4H+ + NO3– + 3e → NO + 2H2O || Ag+ + e → Ag↓ ⇒ ne = 0,14 mol.
● Do ne : nFe = 2,8 ⇒ Fe tan hết. Lại có: nNO3– = ne = 0,14 mol.
⇒ mmuối = mFe + mNO3 = 2,8 + 0,14 × 62 = 11,48(g)

Đáp án A
2Cu(NO3)2+2H2O→2Cu+4HNO3+O2
Hai chất tan sau khi điện phân là x mol Cu(NO3)2 và x mol HNO3
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
0,375x x
Fe + Cu2+→Fe2++Cu
x x x
=> m giảm = 56(0,375x+x)-64x = 1,56 => x = 0,12 mol => nO2 = 0,03 mol
n e = 4nO2 = 0,12 mol
=>t = 0,12.96500/3 = 3860 giây

ĐÁP ÁN D
nCu tạo ra = 2x; nO2 = x (bảo toàn e); 64.2x + 32x = 72;
=> x = 0,45 mol; nH+ = 4.nO2 = 1,8 mol; nCu2+ dư = y mol;
bảo toàn e: 2.nFe = 2y + 3.nNO ; nNO = 1/4.nH+ = 0,45 mol;
(1,2 - nFe).56 + 64y = 31,2; giải hệ
=> nFe phản ứng = 0,9; nCu2+ dư = y = 0,225 mol;
=> nCu2+ ban đầu = 0,9 + 0,225 = 1,125 mol;
=> a = 1,125/0,3 = 3,75 mol






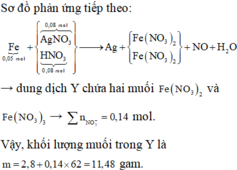

Chọn đáp án A
Dung dịch giảm 9,28 gam là do Ag2O →nAg2O = 0,04 mol → đọc ra nHNO3 trong X = 0,08 mol.
X chứa hai chất tan cùng nồng độ mol → X gồm 0,08 mol AgNO3 và 0,08 mol HNO3.
Phản ứng: 0,05 mol Fe tác dụng với 0,08 mol AgNO3 và 0,08 mol HNO3.
Các chất tham gia đều biết số lượng → cần tỉ lệ để xét xem các chất nào đủ dư hay như thế nào.
Quá trình nhận electron:
Ag+ + e →Ag
4H+ + NO3- + 3e →NO + 2H2O
→∑nelectron nhận tối đa = 0,14 mol.
Quá trình nhường electron:
Fe →Fe2+ + 2e
Fe →Fe3+ + 3e
→ 0,05x2 ≤ ∑nelectron nhường ≤ 0,05x3.
Nhận xét: 0,14 ϵ (0,1; 0,15) nên Fe phản ứng hết thu được cả muối Fe2+ và Fe3+.
« Xử lý nhanh: ∑nNO3-trong muối Fe = ∑ne cho nhận = 0,14 mol.
Suy ra yêu cầu: ∑mmuối trong dung dịch Y = 2,8 + 0,14 x 62 =11,48 gam