K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Các câu hỏi dưới đây có thể giống với câu hỏi trên

22 tháng 11 2018
Chọn A.
Tại thời điểm t (s) tại anot thu được khí Cl2 (0,05 mol) Þ ne (1) = 0,1 mol
Tại thời điểm 3,5t (s) tại anot có:
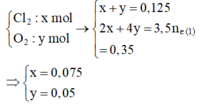
![]() và dung dịch Y chứa Cu2+ dư (a mol), H+ (0,2 mol), NO3-, K+
và dung dịch Y chứa Cu2+ dư (a mol), H+ (0,2 mol), NO3-, K+
Khi cho Y tác dụng với Fe thì: nFe pư =
= 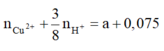
Chất rắn thu được gồm Fe dư và Cu Þ 20 – 56.(a + 0,075) + 64a = 16,4 Þ a = 0,075
Vậy dung dịch X gồm Cu(NO3)2 (0,25 mol) và KCl (0,15 mol) Þ m = 58,175 (g).




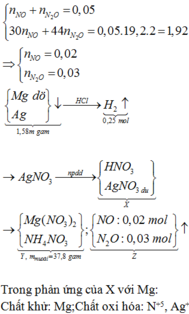








Giải thích: Đáp án C
Khi điện phân AgNO3 :
Catot : Ag+ + 1e -> Ag
Anot : 2H2O -> 4H+ + 4e + O2
- Mg + X thu được hỗn hợp kim loại => Ag+ dư
- Hỗn hợp kim loại + HCl => nMg = nH2 = 0,005 mol => nAg = 0,002 mol
Hỗn hợp khí là sản phẩm khử của Mg với H+ và NO3- (Mg dư)
nNO + nN2O = 0,005 mol
mNO + mN2O = 2.19,2.0,005 = 0,192g
=> nNO = 0,002 ; nN2O = 0,003 mol
Gọi nNH4NO3 = x mol
Bảo toàn e : nMg(NO3)2 = nMg + HNO3 + nMg + Ag+ = ½ (3nNO + 8nN2O + 8nNH4NO3) + ½ nAg
= ½ (3.0,002 + 8.0,003 + 8x) + ½ .0,002 = 0,016 + 4x
=> mmuối = mMg(NO3)2 + mNH4NO3 = 148(0,016 + 4x) + 80x = 3,04g
=> x = 0,001 mol
=> nH+(X) = 4nNO + 10nN2O + 10nNH4NO3 = 0,048 mol = ne
Định luật Faraday : ne.F = It => t = 2316 (s)