Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : B
Gọi số mol CuSO4 và NaCl lần lượt là 2x và 5x mol
Chất tan trong dung dịch chắc chắn có Na2SO4
Vì dung dịch Y phản ứng với Al tạo khí
mà nCl > 2nCu
=> chắc chắn chất còn lại là NaOH
=> Cu2+ và Cl- bị điện phân hết
Các quá trình có thể xảy ra
Catot :
Cu2+ + 2e -> Cu
2H2O + 2e -> H2 + 2OH-
Anot :
2Cl- -> Cl2 + 2e
2H2O -> 4H+ + O2 + 4e
n O H = 2 / 3 n H 2 = 0 , 1 m o l
Vì sau khi điện phân sau các quá trình trên chỉ là điện phân H2O
-> H2 và O2 không ảnh hưởng đến các ion trong dung dịch
=> nOH + 2nCu = nCl
=> 0,1 + 4x = 5x
=> x = 0,1 mol
m g i ả m = m C u + m C l 2 + m H 2 + m H 2 O
⇒ n H 2 O đ p s a u = 0 , 1 m o l
⇒ n e t r a o đ ổ i = 0 , 7 m o l
=> t = 9,72h

Dd có 0,5a mol CuSO4 và 0,5 mol NaCl.
Trong quá trình điện phân giả sử xảy ra :
+ Catot: Cu2+ → + 2e Cu
2H2O + 2e → 2OH- + H2
+ Anot: 2Cl- → Cl2 + 2e
ne trao đổi = 0,3 mol
=> nCl2= 0,15 mol ; nCu= 0,5a mol ; nH2= (0,3-a) mol
m giảm = m Cl2 + mCu + mH2
=> 17,15 = 71.0,15 + 64.0,5a + 2(0,3-a) => a=0,2 M
=>A

Đáp án : B
Điện phân hỗn hợp. CuSO4 x mol , NaCl 3x mol.
- Thứ tự điện phân trong dung dịch :
Cu2+ + 2Cl- à Cu↓ + Cl2 ↑ (1)
(mol) x 2x x x
hết Cu2+ : 2Cl- + 2H2O à 2OH- + H2 ↑ + Cl2 ↑ (2)
(mol) x x 0,5x 0,5x
Dung dịch Y chứa hai chất tan là Na2SO4 và NaOH => Hết ion Cl-
- Tính số mol OH- theo số mol H2:
2Al + 2OH- + 2H2O à 2AlO2- + 3H2 ↑
(mol) x = 0,05 ß---------------------0,075
- Khối lượng dung dịch giảm:
64.0,05 + 71.0,05 + 71.0,5.0,05 + 2.0,5.0,05 = 8,575 < 10,375 gam => H2O bị điện phân
Khối lượng H2O bị điện phân : 10,375 – 8,575 = 1,8 gam , số mol H2O bị điện phân 0,1 mol.
- Phương trình điện phân của H2O :
2H2O → N a O H d p d d 2H2↑ + O2↑ (3)
(mol) 0,1 0,1 0,05
- tính số mol electron trao đổi anot : Cl2 (0,075 mol, O2 (0,05 mol).
Số mol electron trao đổi = 2.0,075 + 4.0,05 = 0,35 mol.
Hoặc tại catot : Cu (0,05 mol) , H2 (0,025 + 0,1) mol cũng tương tự
Số mol electron trao đổi = 2.0,05 + 2.0,125 = 0,35 mol.
ne = It/26,8 , thay số : 0,35 = 1,34t/26,8 => t = 7.

Đáp án : B
nCuSO4 = x ; nNaCl = 3x mol
Catot :
Cu2+ + 2e -> Cu
,x 2x
2H2O + 2e -> 2OH- + H2
, x = 0,05 0,05
Anot :
2Cl- -> Cl2 + 2e
,3x 1,5x 3x
2H2O -> 4H+ + O2 + 4e
(Al + dd X => H2 => Chứng tỏ có H+ hoặc OH- nhưng vì nCl- = 3nCu2+ nên theo thứ tự điện phân thì Catot điện phân nước trước)
( nOH = 2/3nH2 = 0,05 mol )
Dung dịch chứa 2 chất tan là Na2SO4 và NaOH (Cl- điện phân hết)
,mgiảm = mCu + mCl2 + mH2O đp + mH2
=> nH2O đp = 0,1 mol => nO2 = 0,05 mol
=> ne trao đổi = nCl- + 4nO2 = 0,35 mol
=> t = 7 h

Đáp án : D
Khi nhúng thanh sắt vào X thì tạo khí NO => có H+
Các quá trình có thể xảy ra :
Catot :
Cu2+ + 2e -> Cu
2H2O + 2e -> 2OH- + H2
Anot :
2Cl- -> Cl2 + 2e
2H2O -> 4H+ + O2 + 4e
+) TH1 : Cu2+ còn dư ; catot chưa điện phân nước
Gọi nH+ tạo ra = a mol => nO2 = 0,25a mol
=> ne = 2nCu2+ pứ = nCl- + nH+ => nCu2+ pứ = 0,1 + 0,5a (mol)
=> mgiảm = 64.(0,1 + 0,5a) + 32.0,25a + 0,1.71 = 21,5g
=> a = 0,2 mol
Số mol Cu2+ còn dư là (x – 0,2) mol
Vì nH+ = 0,2 < ½ nNO3- => H+ hết và chỉ phản ứng đến Fe2+ (Fe dư)
=> mthanh giảm = mFe pứ - mCu tạo ra
=> 2,6 = 56.(0,2.3/8 + x – 0,2) – 64.(x – 0,2)
=> x = 0,4 (Có đáp án thỏa mãn)
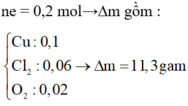


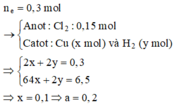
Hướng dẫn giải:
Đáp án B