Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

So sánh các phản ứng của hỗn hợp X với oxi và hỗn hợp Y với dung dịch HCl, ta thấy :
n HCl = 2 n trong oxit ; m O 2 = 8,7 - 6,7 = 2g
n O trong oxit = 0,125 mol; n HCl = 0,25 mol
V HCl = 0,25/2 = 0,125l

Ag không tác dụng với oxi và HCl => 2,7g chất rắn không tan là Ag.
PTHH: Hỗn hợp X với oxi:
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(2Cu+O_2\underrightarrow{t^o}2CuO\)
PTHH: Hỗn hợp chất rắn Y với HCl:
\(Fe_3O_4+8HCl\rightarrow FeCl_2+2FeCl_3+4H_2O\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\)
So sánh các phản ứng của hỗn hợp X với oxi và hỗn hợp Y với HCl, ta thấy:
\(n_{HCl}=2n_{\left(trongoxit\right)}\)
\(m_{O_2}=8,7-6,7=2\left(g\right)\)
\(n_{O\left(trongoxit\right)}=0,125\left(mol\right)\)
\(\Rightarrow n_{HCl}=0,125.2=0,25\left(mol\right)\)
\(\Rightarrow V_{HCl}=\dfrac{0,25}{2}=0,125\left(l\right)\)

a) PTHH: 2Al + 6 HCl -> 2 AlCl3 + 3 H2
x___________3x______________1,5x(mol)
Fe +2 HCl -> FeCl2 + H2
y___2y____y______y(mol)
b) Ta có: m(rắn)= mCu=0,4(g)
=> m(Al, Fe)=1,5-mCu=1,5-0,4=1,1(g)
nH2= 0,04(mol)
Ta lập hpt:
\(\left\{{}\begin{matrix}27x+56y=1,1\\1,5x+y=0,04\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,02\\y=0,01\end{matrix}\right.\)
=> mAl=27.0,02=0,54(g)
mFe=56.0,01=0,56(g)

Em tham khảo nhé !
Đặt nAl = a và nFe = b
—> 27a + 56b = 3,28 (1)
nHCl = 0,5 và nNaOH = 0,65
—> nNaCl = 0,5
TH1: Nếu kết tủa vẫn còn Al(OH)3 —> nNaAlO2 = 0,65 – 0,5 = 0,15
Kết tủa gồm Fe(OH)2 (b) và Al(OH)3 (a – 0,15)
Nung ngoài không khí —> Al2O3 (a – 0,15)/2 và Fe2O3 (b/2)
m rắn = 102(a – 0,15)/2 + 160b/2 = 1,6 (2)
(1)(2) —> Vô nghiệm, loại
TH2: Kết tủa chỉ có Fe(OH)2 (b mol)
—> m rắn = 160b/2 = 1,6 (3)
(1)(3) —> a = 0,08 và b = 0,02
—> %Al = 65,85% và %Fe = 34,15%

Câu 2:
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\\ n_{Al}=\dfrac{2.0,6}{3}=0,4\left(mol\right)\\ \%m_{Al}=\dfrac{0,4.27}{12}.100\%=90\%\Rightarrow\%m_{Ag}=100\%-90\%=10\%\)
Câu 3:
\(n_{H_2}=\dfrac{0,6}{2}=0,3\left(mol\right)\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\\ n_{Al}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ n_{Al_2O_3}=\dfrac{25,8-0,2.27}{102}=0,2\left(mol\right)\\ n_{AlCl_3}=n_{Al}+2n_{Al_2O_3}=0,2+2.0,2=0,6\left(mol\right)\\ m_{AlCl_3}=133,5.0,6=80,1\left(g\right)\)

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl -->ZnCl2 + H2
____0,2<----------------------0,2
=> mZn = 0,2.65 = 13 (g)
mCu = mrắn không tan = 19,5 (g)
\(\left\{{}\begin{matrix}\%Zn=\dfrac{13}{13+19,5}.100\%=40\%\\\%Cu=\dfrac{19,5}{13+19,5}.100\%=60\%\end{matrix}\right.\)
`n_(H_2)=4,48/22,4=0,2 (mol)`
Ta có PTHH: `Zn+2HCl --> ZnCl_2 +H_2`
Theo PT: `1`--------------------------------`1`
Theo đề: `0,2`------------------------------`0,2`
`m_(Zn)=0,2.65=13(g)`
Vì `Cu` không phản ứng với `HCl` nên `m_(chất rắn không tan)=m_(Cu)=19,5(gam)`
`%Zn=13/(13+19,5) .100%=40%`
`%Cu=100%-40%=60%`


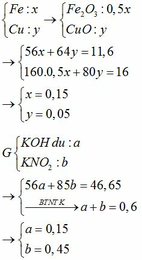
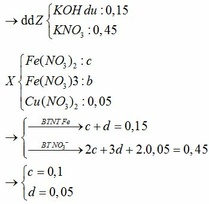

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%
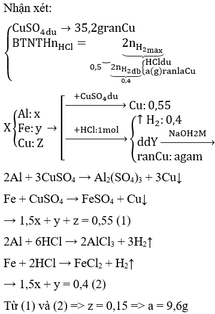
Phương trình hoá học của phản ứng :
Ag không tác dụng với oxi, không tác dụng với dung dịch HCl nên 2,7 garn chất rắn không tan là Ag.
Hỗn hợp kim loại với oxi.
4Al + 3 O 2 → 2 Al 2 O 3
3Fe + 2 O 2 → Fe 3 O 4
2Cu + O 2 → 2CuO
Hỗn hợp chất rắn Y với dung dịch HCl
Al 2 O 3 + 6HCl → 2Al Cl 3 + 3 H 2 O
Fe 3 O 4 + 8HCl → Fe Cl 2 + 2Fe Cl 3 + 4 H 2 O
CuO + 2HCl → Cu Cl 2 + H 2 O