Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nO/X = (5,92 – 4,16) ÷ 16 = 0,11 mol
[O] + 2HCl → 2Cl + H2O ⇒ nCl– = 2nO = 0,22 mol.
Đặt nMg = x; nFe = y ⇒ 24x + 56y = 4,16(g).
Rắn gồm x mol MgO và 0,5y mol Fe2O3
⇒ 40x + 160.0,5y = 6(g)
⇒ giải hệ có: x = 0,01 mol; y = 0,07 mol.
Bảo toàn electron cả quá trình:
2nMg + 3nFe = 2nO + nAg ⇒ nAg = 2 × 0,01 + 3 × 0,07 - 2 × 0,11 = 0,01 mol.
► Kết tủa gồm 0,01 mol Ag và 0,22 mol AgCl
⇒ m = 0,01 × 108 + 0,22 × 143,5 = 32,65(g).
Đáp án C

Đáp án A
Hòa tan hết 7,44 gam hỗn hợp rắn vào 0,4 mol HCl và 0,05 mol NaNO3 thu được 22,47 gam muối và 0,02 mol hỗn hợp khí gồm NO và N2.
Giải được số mol NO và N2 đều là 0,01 mol.
Do X chứa muối nên HCl phản ứng hết.
BTKL:
![]()
BTNT H:
![]()
Cho NaOH dư vào X thu được kết tủa Y, nung Y trong không khí thu được rắn chứa MgO và Fe2O3 có khối lượng 9,6 gam.
Lượng O để oxi hóa hỗn hợp ban đầu lên tối đa là:
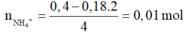
Cho AgNO3 dư tác dụng với dung dịch X ta thu được kết tủa gồm AgCl 0,4 mol (bảo toàn C) và Ag.
Bảo toàn e:
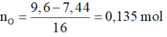
n A g = 0,135.2 - 0,01.8 - 0,013 - 0,01.10 = 0,06 mol
![]()

Đáp án A
Đặt số mol Mg, F e 3 O 4 v à F e ( N O 3 ) 2 lần lượt là x, y , z mol
Hỗn hợp khí có 30 > M > 21,6 > 2 và có 1 khí hóa nâu => Z gồm NO: a mol và H 2 : b mol
Khi đó ta có hệ 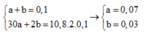
Vì sinh ra H 2 nên toàn bộ lượng N O 3 - trong F e ( N O 3 ) 2 v à H N O 3 chuyển hóa thành NO: 0,07 mol và N H 4 +
Bảo toàn nguyên tố N ![]()
Luôn có ![]()
![]()
![]()
![]()
Trong 20,8 gam chất rắn gồm MgO: x mol và ![]()
Ta có hệ 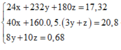
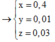
Bảo toàn electron cho toàn bộ quá trình ![]()
![]()
=>Kết tủa thu được AgCl: 1,04 mol, Ag: 0,01 mol ![]() = 150,32 gam
= 150,32 gam


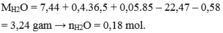


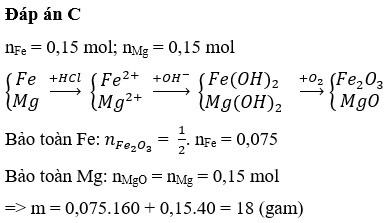





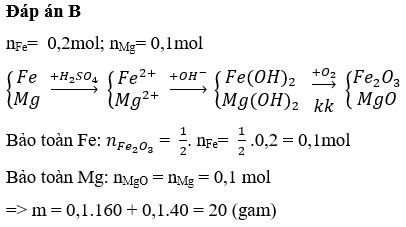
Cách 1: Trước hết ta tóm tắt sơ đồ phản ứng để dễ dàng nắm bắt nội dung của bài toán:
+ Bảo toàn nguyên tố Mg: nMgO = nMg = a mol
+ Bảo toàn nguyên tố Fe:
Bây giờ ta đi tìm a, b.
+ Từ đó ta có hệ:
+ Bảo toàn khối lượng: mO(X) = 5,92 - 4,16 = 1,76 g
+ Như vậy ta có: mkết tủa =mAg + mAgCl , mà đã có được nAgCl, nên công việc của ta là đi tính khối lượng Ag.
Để tính được Ag, ta cần phải xác định được các trạng thái số oxi hóa của các nguyên tố có sự thay đổi số oxi hóa là Mg, Fe, O và Ag, dựa vào sơ đồ phản ứng ở trên ta dễ dàng tính được mAg.
+ Bảo toàn electron ta có các quá trình
+ Do đó 2nMg + 3nFe = 2nO(X) + nAg
⇒2.0,01+ 3.0,07 = 2.0,11+nAg ⟹nAg =0,01 mol
Suy ra mkết tủa = mAg +mAgCl =0,01.108 + 0,22.143,5 = 32,65 g
Cách 2: Ta sẽ không cần tìm a, b như trên, thay vào đó ta sẽ sử dụng giả thiết “hỗn hợp X chỉ gồm các oxit” :
+ Nung Z trong không khí được 6 gam chất rắn là Fe2O3.
+ Bảo toàn khối lượng: mO(X) = 5,92 - 4,16 = 1,76 g
+ Bảo toàn nguyên tố:
+ Tương tự như trên ta cần phải tính được nAg, dễ thấy 6 g rắn khi nung Z > mX(5,92)
⇒ Trong X phải có FeO, vì “hỗn hợp X chỉ gồm các oxit” nên ta coi X chỉ gồm 2 oxit là FeO và Fe2O3.
Do đó khối lượng O dùng để oxi hóa Fe2+ trong X thành Fe3+ là:
+ Như vậy bảo toàn electron, thì số mol:
+ Nên nAg = nFe2+ = 2nO = 2.0,005 = 0,01 mol
⇒ m↓ = mAg +mAgCl =0,01.108 + 0,22.143,5 = 32,65 g
Đáp án A