
![]()
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

![]()
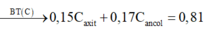
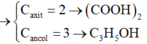
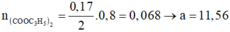

Đáp án A
Vì nH2O > nCO2 → ancol no, đơn chức
Gọi công thức của axit là CnH2nO2 và ancol là CmH2m+2O ( với n khác m)
Luôn có nancol = nH2O - nCO2= 0,1 mol
Có nO = 7 , 6 - 0 , 13 × 12 - 0 , 42 16 = 0,2 mol
→ naxit = 0 , 2 - 0 , 1 2 =0,05 mol
→ 0,1n + 0,05m = 0,3 → 2n + m = 6 → n= 1, m=2 hoặc n=m = 2 ( Loại)
Vậy ancol là CH3OH: 0,1 mol và axit là C3H7COOH: 0,05 mol
Thực hiện phản ứng este hóa hỗn hợp với H = 80%
→ meste = 0,8. 0,05. 102= 4,08 gam

Đáp án C
Vì axit và ancol đều no, đơn chức, mạch hở nên khi đốt cháy hỗn hợp ta có:
n H 2 O - n C O 2 = n a n c o l = 0 , 1 ( m o l ) C ó m X = m C + m H + m O = 12 n C O 2 + 2 n H 2 O + 16 n O t r o n g X ⇒ n O t r o n g X = 0 , 32 ( m o l )
Ancol đơn chức
n O t r o n g a n c o l = n a n c o l = 0 , 1 ( m o l ) ⇒ n O t r o n g a x i t = 0 , 22 ( m o l ) ⇒ n a x i t = 0 , 11 ( m o l )
Gọi số C trong axit và ancol lần lượt là x,y
n O t r o n g a n c o l = n a n c o l = 0 , 1 ( m o l ) ⇒ n O t r o n g a x i t = 0 , 22 ( m o l ) ⇒ n a x i t = 0 , 11 ( m o l )
Ta dễ dàng suy ra: x = 4; y = 1
=> axit là C3H7COOH; ancol là CH3OH
V ậ y e s t e l à C 3 H 7 C O O C H 3 ; n e s t e = 80 % n a n c o l = 0 , 08 ( m o l ) m e s t e = m = 8 , 16 ( g )
Chú ý: Ở bài toán này, nhiều bạn có thể sẽ rơi vào sai lầm như sau:
Sau khi tính được naxit ta thấy ancol phản ứng hết ⇒ n H 2 O = 80 % n a n c o l = 0 , 08 ( m o l )
Sau đó bảo toàn khối lượng:
⇒ m e s t e = 12 , 88 - m H 2 O = 11 , 44 ( g ) H o ặ c n H 2 O = n a n c o l = 0 , 1 ( m o l ) ⇒ m e s t e = 80 % ( 12 , 88 - m H 2 O ) = 8 , 864 ( g )
Cả 2 cách làm trên đều sai vì công thức bảo toàn khối lượng là: m a x i t p h ả n ứ n g + m a n c o l p ả n ứ n g = m e s t e + m H 2 O mà ở đây axit và ancol không phản ứng vừa đủ với nhau. Nên ta không thể áp dụng bảo toàn khối lượng mà bắt buộc phải tìm công thức của axit và ancol từ đó tìm công thức của este.

Chọn đáp án D
7,6(g) X + ?O2 → 0,3 mol CO2 + 0,4 mol H2O. Bảo toàn khối lượng:
||⇒ mO2 = 0,3 × 44 + 0,4 × 18 - 7,6 = 12,8(g) ⇒ nO2 = 0,4 mol. Bảo toàn nguyên tố Oxi:
nO/X = 0,3 × 2 + 0,4 – 0,4 × 2 = 0,2 mol. Do nCO2 < nH2O ⇒ ancol no, đơn chức, mạch hở.
Ta có: nCO2 – nH2O = (k – 1).nHCHC (với k là độ bất bão hòa của HCHC).
► Áp dụng: nancol = ∑nH2O - ∑nCO2 = 0,1 mol ⇒ naxit = (0,2 - 0,1) ÷ 2 = 0,05 mol.
Đặt số C của axit và ancol là a và b ⇒ 0,1a + 0,05b = 0,3 → a k h á c b a , b ≥ 1 a = 1 và b = 4
⇒ X gồm HCOOH và C4H9OH. Do naxit < nancol ⇒ hiệu suất tính theo axit.
► Este là HCOOC4H9 với số mol 0,04 ⇒ m = 0,04 × 102 = 4,08(g) ⇒ chọn D

Chọn đáp án C
nCO2 = 0,34 mol < nH2O = 0,5 mol
⇒ 2 ancol no, đơn chức, mạch hở.
Đặt ∑nancol = x; neste = y
⇒ nX = x + y = 0,2 mol.
Bảo toàn nguyên tố Oxi:
⇒ nO/X = 0,26 mol = x + 4y
⇒ x = 0,18 mol; y = 0,02 mol.
Bảo toàn khối lượng:
mX = 14,96 +9 -0,46 × 32=9,24(g).
⇒ Thí nghiệm 2 dùng gấp 18,48 ÷ 9,24 = 2 lần thí nghiệm 1.
18,48(g) X chứa 0,36 mol hỗn hợp ancol và 0,04 mol este.
⇒ nNaOH phản ứng = 0,04 × 2 = 0,08 mol.
Bảo toàn khối lượng:
mY = 18,48 + 0,08 × 40 - 5,36 = 16,32(g)
nY = 0,36 + 0,04 × 2 = 0,44 mol.
Lại có: 2 ancol → 1 ete + 1 H2O
⇒ nH2O = 0,44 ÷ 2 = 0,22 mol.
Bảo toàn khối lượng:
m = 0,8 × (16,32 - 0,22 × 18) = 9,888(g)