Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình điều chế hiđro
CH4 + 2H2O -to, xt→ CO2 + 4H2
Phương trình loại khí oxi:
CH4 + 2O2 -to→ CO2 + 2H2O
Phương trình tống hợp amoniac:
N2 + 3H2 -450-500o, Fe, 200-300atm→ 2NH3

1 tấn = 1000 kg
\(\rightarrow n_{C_6H_6}=\dfrac{1000}{78}=\dfrac{500}{39}\left(mol\right)\)
PTHH: C6H6 + HNO3 \(\overrightarrow{H_2SO_4đặc}\) C6H5NO2 + H2O
\(n_{C_6H_5NO_2\left(tt\right)}=\dfrac{500}{39}.80\%=\dfrac{400}{39}\left(mol\right)\)
\(\rightarrow m_{C_6H_5NO_2}=\dfrac{400}{39}.123=\dfrac{16400}{13}\left(g\right)\)

CH4 + 2H2O 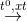 CO2 + 4H2
CO2 + 4H2
CH4 + 2O2 (kk) 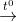 CO2 + 2H2O nên còn lại N2
CO2 + 2H2O nên còn lại N2
N2 + 3H2 ⇔ 2NH3

Đáp án A
Hỗn hợp khí gồm CH4, C2H6 và C3H8 là các hidrocacbon.
Mà khi đốt cháy 1 hidrocacbon bất kì ta luôn có:
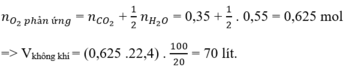

Đáp án A
n C O 2 = 7 , 84 22 , 4 = 0 , 35 ( m o l ) ; n H 2 O = 9 , 9 18 = 0 , 55 ( m o l )
Bảo toàn nguyên tố O:
2 n O 2 = 2 n C O 2 + n H 2 O ⇒ n O 2 = 0 , 625 ( m o l ) ⇒ V O 2 = 0 , 625 . 22 , 4 = 14 l
Vì oxi chiếm 1/5 Vkk => Vkk = 5.14 = 70 (lít)

Đáp án B
Ta có trong 10 lít khí thiên nhiên có 9,6 lít CH4; 0,2 lít N2 và 0,2 lít CO2.
Đốt cháy khí thiên nhiên có phản ứng hóa học sau:
CH4 + 2O2 → t o CO2 + 2H2O
Ở cùng điều kiện nhiệt độ và áp suất thì tỉ lệ về thể tích cũng là tỉ lệ về số mol.
→ Cứ 9,6 lít CH4 phản ứng cần 9,6.2 = 19,2 lít O2.
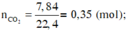
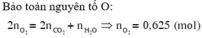
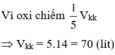
Thuốc trừ sâu : \(C_6H_6Cl_6\)
\(n_{CH_4} = \dfrac{448.1000.95\%}{22,4} = 19 000(mol)\)
Bảo toàn nguyên tố với C:
\(n_{C_6H_6Cl_6} = \dfrac{1}{6}n_{CH_4} = \dfrac{9500}{3}(mol)\\ \Rightarrow m_{C_6H_6Cl_6} = \dfrac{9500}{3}.291=921500(gam)\)
VCH4 = 0.95*448000 = 425600 (l)
nCH4 = 425600/22.4 = 19000 (mol)
BT C :
nC6H6Cl6 = nCH4/6 = 19000/6 = 9500/3 (mol)
mC6H6Cl6 = 9500/3 * 291 = 9215000 (g) = 9215 (kg)