Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi khối lượng NaCl trong 1900 gam dd NaCl bão hòa ở 90oC là a (gam)
Có: \(S_{NaCl\left(90^oC\right)}=\dfrac{a}{1900-a}.100=50\)
=> a = \(\dfrac{1900}{3}\left(g\right)\)
=> \(m_{H_2O}=1900-\dfrac{1900}{3}=\dfrac{3800}{3}\left(g\right)\)
Gọi khối lượng NaCl trong dd NaCl bão hòa ở 0oC là b (gam)
Có: \(S_{NaCl\left(0^oC\right)}=\dfrac{b}{\dfrac{3800}{3}}.100=35\)
=> \(b=\dfrac{1330}{3}\left(g\right)\)
=> mNaCl (tách ra) = \(\dfrac{1900}{3}-\dfrac{1330}{3}=190\left(g\right)\)
\(m_{NaCl\left(tách\right)}=m_{NaCl\left(dd.bão.hoà.90^oC\right)}-m_{NaCl\left(dd.bão.hoà.0^oC\right)}\\ =\dfrac{1900}{100}.50-\dfrac{1900}{100}.35=285\left(g\right)\)
Em xem có gì không hiểu thì hỏi lại nha!

Đáp án D
Trong 140 gam dung dịch KClO3 bão hòa ở 80°C có 40 gam KClO3. Nên trong 350 gam dung dịch KClO3 bão hào ở 80°C có 100 gam KClO3.
Trong 108 gam dung dịch KClO3 bão hòa ở 20°C có 8 gam KClO3. Gọi số gam KClO3 tách ra khỏi dung dịch là a. Khi đó khối lượng dung dịch và khối lượng KClO3 trong dung dịch thu được lần lượt là 350 – a và 100 – a (gam).
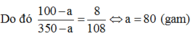

Câu 1 :
$CuO + H_2SO_4 \to CuSO4 + H_2O$
n CuSO4 = n H2SO4 = n CuO = a(mol)
m dd H2SO4 = a.98/20% = 490a(gam)
m dd = 80a + 490a = 570a(gam)
n CuSO4.5H2O = 30,7/250 = 0,1228(mol)
Sau khi tách tinh thể :
n CuSO4 = a - 0,1228(mol)
m dd = 570a - 30,7(gam)
Áp dụng CT : C% = S/(S + 100) .100%. Ta có :
\(C\%_{CuSO_4} = \dfrac{160(a-0,1228)}{570a-30,7}.100\% = \dfrac{17,4}{100+17,4}.100\%\\ \Rightarrow a = 0,2(mol)\)
Câu 1.2 :
Gốc R đều là gốc no.
n CO2 = 13,44/22,4 = 0,6(mol)
n H2O = 10,44/18 = 0,58(mol)
Khi đốt cháy hợp chất hữu cơ chứa C,H,O , ta có :
n CO2 - n H2O = (k -1).n X , trong đó k là độ bất bão hòa
Ta thấy este có k = 3(3 liên kết pi trong gốc -COO-) , axit có k = 1( 1 liên kết pi trong gốc -COOH)
Do đó :
n CO2 - n H2O = 0,6 - 0,58 = (3 - 1).n este + (1 -1).n axit
Suy ra n este = 0,05(mol)
n este pư = 0,05.90% = 0,045(mol)
$(RCOO)_3C_3H_5 + 3NaOH \to 2RCOONa + C_3H_5(OH)_3$
n glixerol = n este pư = 0,045(mol)
m glixerol = 0,045.92 = 4,14(gam)

H2SO4 + nSO3 => H2SO4.nSO3
H2SO4.nSO3 + nH2O >> n+1H2SO4
H2SO4 + 2NaOH >> Na2SO4 + 2H2O
Số mol NaOH = 0,008 , số mol H2SO4 200ml = 0,008/2 . 200/10 =0,08
Theo (2) nH2SO4.nSO3 =0,08/n+1
MH2SO4.nSO3 =98 +80n = 6,76/0,08/n+1 =84,5n+ 84,5
13,5 =4,5n
=>n=3
%SO3=3.80/2.80+98 =71%
c,Theo câu b , hàm lượng % của SO3 có trong oleum trên là 71
Cứ 100g oleum có 71g SO3 và 29g H2SO4 Khi đó mdd = 1,31.100 = 131g
a g có 71a/100 ...............29a/100
Vì dd H2SO4 có C=40%
Cứ 100g dd có 40g H2SO4 và 60g H2O
=>131g >> 131.40/100 = 52,4g H2SO4 và 131.60/100 = 78,6 g H2O
Khi cho oleum vào dd H2SO4 thì SO3+H2O
SO3 + H2O >> H2SO4
Cứ 80g cần 18g >> 98g
Vậy ..x..g cần 78,6g >>..y..g
x= 78,6.80/18 = 349,3g
y= 78,6.98/18 = 427,9g
Trong loại oleum mới 10% thì mSO3 = 71a/100 -349,3g
và mH2SO4 = 29a/100 +52,4+ 427,9
=> 71a/100 -349,4 / 29a/100 +480,3 = 10/90
=> Bạn ấn máy tìm a nhé

Đặt công thức của tinh thể ngậm nước tách ra là MgSO4.nH2O
Trong 120 + 18n gam MgSO4.nH2O có 120 gam MgSO4 và 18n gam H2O
1,58 gam 0,237n gam
Khối lượng các chất trong 100 gam dung dịch bão hoà:
\(m_{H_2}=\frac{100.100}{35,1+100}=74,02g\)
\(m_{MgSO_4}=\frac{100.35,1}{35,1+100}\) = 25,98 gam
Khối lượng các chất trong dung dịch sau khi kết tinh:
\(m_{H_2O}\) = 74,02 – 0,237n gam
\(m_{MgSO_4}\)= 25,98 + 1 – 1,58 = 25,4 gam
Độ tan: s = \(\frac{25,4}{74,02-0,237n}.100=35,1\) . Suy ra n = 7.
Vậy công thức tinh thể ngậm nước kết tinh là MgSO4.7H2O

a) \(Na_2O+H_2O\rightarrow2NaOH\)
\(n_{NaOH}=2n_{Na_2O}=2.\dfrac{11,16}{62}=0,32\left(mol\right)\)
\(C\%_{NaOH}=\dfrac{0,32.40}{11,16+88,84}.100=12,8\%\)
b) \(n_{Fe}=\dfrac{4,48}{56}=0,08\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{H_2}=n_{Fe}=0,08\left(mol\right)\\ \Rightarrow V_{H_2}=0,08.22,4=1,792\left(lít\right)\)
\(n_{HCl}=2n_{Fe}=0,16\left(mol\right)\)
\(m_{ddHCl}=\dfrac{0,16.36,5}{7,3\%}=80\left(g\right)\)
\(n_{FeCl_2}=n_{Fe}=0,08\left(mol\right)\\ m_{ddsaupu}=4,48+80-0,08.2=84,32\left(g\right)\)
\(C\%_{FeCl_2}=\dfrac{0,08.127}{84,32}.100=12,05\%\)

$a)PTHH:2Al+6HCl\to 2AlCl_3+3H_2$
$n_{H_2}=\dfrac{5,04}{22,4}=0,225(mol)$
$\Rightarrow n_{Al}=0,15(mol)$
$\Rightarrow \%m_{Al}=\dfrac{0,15.27}{9,45}.100\%\approx 42,86\%$
$\Rightarrow \%m_{Cu}=100-42,86=57,14\%$
$b)$ Theo PT: $n_{HCl}=2n_{H_2}=0,45(mol)$
$\Rightarrow C_{M_{HCl}}=\dfrac{0,45.110\%}{0,5}=0,99M$

\(n_Y=\dfrac{6,72}{22,4}=0,3mol\)
\(2R+2HCl\rightarrow2RCl+H_2\)
0,6 0,6 0,6 0,3
Mà \(n_R=\dfrac{23,4}{M_R}=0,6\Rightarrow M_R=39\left(K\right)\)
\(m_{HCl}=0,6\cdot36,5=21,9\left(g\right)\)
\(\Rightarrow m_{ddHCl}=\dfrac{21,9}{25}\cdot100=87,6\left(g\right)\)
\(m_{H_2}=0,3\cdot2=0,6\left(g\right)\)
\(m_{KCl\left(lt\right)}=0,6\cdot74,5=44,7\left(g\right)\)
\(m_{ddsau}=23,4+87,6-0,6=110,4\left(g\right)\)
\(\Rightarrow C\%=\dfrac{44,7}{110,4}\cdot100=40,5\%\)
Nhiệt độ
Chất tan
Dung dịch
10oC
21,7
100
90oC
a + 21,7
100 + a
a + 21,7 = 34,7%.(100 + a) → a = 19,908 (gam)
b) Giả sử nMgSO4.7H2O: b (mol)
Nhiệt độ
Chất tan
Dung dịch
10oC
41,608
119,908
90oC
41,608 – 120b
119,908 – 246b
Suy ra: 41,608 – 120b = 21,7%.(119,908 – 246b) → b = 0,235
→ mMgSO4.7H2O = 57,802
đừng đủi e nx;(