Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : A
dd X : nH+ = 2nH2SO4 + nHCl = 0,02 mol
dd Y : nOH = nNaOH + 2nBa(OH)2 = 0,04 mol
=> Trong Y : nOH – nH+ = 0,02 mol = nOH- => COH = 0,1M => pH = 13

Đáp án A
Ta có nH+=0.02, nOH-=0.04 nên sau phản ứng nOH- = 0,02 và V = 0,2
→ Cm OH- = 0,1 => pH = 1

Chọn A
Ta có nH2SO4 = 0,05.0,1 = 0,005 mol; nHCl = 0,1.0,1 = 0,01 mol
⇒ ∑nH+ = 2nH2SO4 + nHCl = 2.0,005 + 0,01 = 0,02 mol
nNaOH = 0,2.0,1 = 0,02 mol; nBa(OH)2 = 0,1.0,1 = 0,01 mol
⇒ ∑nOH- = nNaOH + 2nBa(OH)2 = 0,02 + 2.0,01 = 0,04 mol
Khi trộn axit với kiềm thì bản chất của phản ứng là:
H+ + OH- → H2O
(0,02) (0,04)
⇒ nOH-còn dư = 0,04 – 0,02 = 0,02 mol ⇒ [OH-] còn dư = 0,02/0,2 = 0,1M
⇒ Dung dịch X có pOH = - lg[OH-]còn dư = 1 ⇒ pH = 14 – 1 = 13

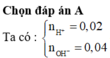
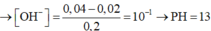

Đáp án A