
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) Gọi số mol Fe, Zn là a, b (mol)
=> 56a + 65b = 12,1 (1)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
a-->2a-------->a---->a
Zn + 2HCl --> ZnCl2 + H2
b---->2b---->b------->b
=> a + b = 0,2 (2)
(1)(2) => a = 0,1 (mol); b = 0,1 (mol)
\(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,1.56}{12,1}.100\%=46,28\%\\\%m_{Zn}=\dfrac{0,1.65}{12,1}.100\%=53,72\%\end{matrix}\right.\)
b) nHCl = 2a + 2b = 0,4 (mol)
=> \(V_{dd.HCl}=\dfrac{0,4}{1}=0,4\left(l\right)\)
c) \(\left\{{}\begin{matrix}C_{M\left(FeCl_2\right)}=\dfrac{0,1}{0,4}=0,25M\\C_{M\left(ZnCl_2\right)}=\dfrac{0,1}{0,4}=0,25M\end{matrix}\right.\)

\(n_{NaCl\left(bđ\right)}=3,65\%.100=3,65\left(g\right)\)
\(\rightarrow m_{NaCl\left(sau.khi.pha\right)}=a+36,5\left(g\right)\\ m_{dd\left(sau.khi.pha\right)}=100+a\left(g\right)\\ \rightarrow C\%_{NaCl\left(7,3\%\right)}=\dfrac{a+3,65}{a+100}=7,3\%\\ \Leftrightarrow a=4\left(g\right)\)


\(\dfrac{2A}{2A+16.5}=\dfrac{43,66}{100}\)
=> \(200A=43,66.\left(2A+16.5\right)\)
=> \(200A-87,32A=3492,8\)
=> \(112,68A=3492,8\)
=> A= 31


gọi KL là A có hoá trị là x
--> CTHH của oxit là: A2Ox
--> VddHCl = 300ml = 0,3l --> nHCL= 0,3.1= 0,3 mol
PT: A2Ox +2x HCl----->2 AClx +x H2O
8/(2A+16x)--0,3
ta có pt toán: 16x/(2A+16x) = 0,3
=> 3A = 56x
biện luận kết quả ta đc
nếu x=I => A= 56/3 loại
nếu x=II => A= 112/3 loại
nếu x=III=> A= 56 chọn
vậy KL A là Fe(sắt) có hoá trị III => CTHH của oxit: Fe2O3
cảm ơn bạn nhưng mình không hiểu ở chỗ kê gam lên cái phương trình á bạn

\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\\
pthh:Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,4 0,4 0,4
\(V_{H_2}=0,4.22,4=8,96l\\
m_{FeCl_2}=0,4.127=50,8g\\
n_{Fe_2O_3}=\dfrac{14}{160}=0,0875\left(mol\right)\\
pthh:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
\(LTL:\dfrac{0,0875}{1}< \dfrac{0,4}{3}\)
=> H2 dư
\(n_{H_2\left(p\text{ư}\right)}=3n_{Fe_2O_3}=0,2625\left(mol\right)\\
m_{H_2\left(d\right)}=\left(0,4-0,2625\right).2=0,275g\\
n_{Fe}=2n_{Fe_2O_3}=0,175\left(mol\right)\\
m_{Fe}=0,175.56=9,8g\)

Số p+số e+số n=28
Số n=28*35.7%=10
->Số p+số e=28-10=18
Mà số p=số e
->Số p= số e=9
-> X là Flo

a) Ta có: O hóa trị II, ta gọi hóa trị Mn cần tìm trong hợp chất MnO2 là x: \(Mn^xO_2^{II}\)
Theo quy tắc hóa trị, ta có:
1.x=2.II
=>x= (2.II)/1= IV
=> Hóa trị x của Mn cần tìm trong hợp chất MnO2 là IV.
a) Ta có: (PO4) hóa trị II, ta gọi hóa trị Mn cần tìm trong hợp chất là y: \(Ba^y_3\left(PO_4\right)^{III}_2\)
Theo quy tắc hóa trị, ta có:
3.y=III.2
=>y=(III.2)/3=II
=> Hóa trị y của Ba cần tìm trong hợp chất Ba3(PO4)2 là II.


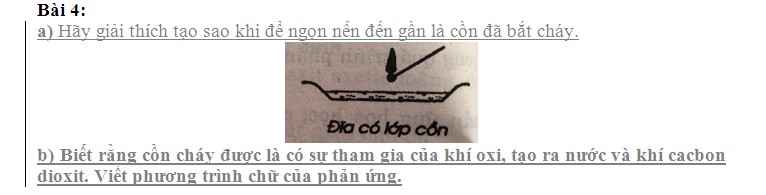 mấy anh chị giải chi tiết giùm em,em cần lời giải chi tiết ạ em xin cảm ơn
mấy anh chị giải chi tiết giùm em,em cần lời giải chi tiết ạ em xin cảm ơn
 giải chi tiết giúp mình c4 ạ. Mình cảm ơn!!!!!!!!
giải chi tiết giúp mình c4 ạ. Mình cảm ơn!!!!!!!!

Gọi kim loại cần tìm là R (II)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_R=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow56a+M_R.b=8\left(g\right)\)
\(n_{HCl}=0,2.2=0,4\left(mol\right)\)
PTHH:
Fe + 2HCl --->FeCl2 + H2
a---->2a
R + 2HCl ---> RCl2 + H2
b---->2b
Theo pthh: \(n_{hhkl}=n_{H_2}=\dfrac{1}{2}n_{HCl}=\dfrac{1}{2}.0,4=0,2\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, Lập được hệ pt: \(\left\{{}\begin{matrix}56a+M_R.b=8\\2a+2b=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,1\left(mol\right)\\M_R=24\left(\dfrac{g}{mol}\right)\end{matrix}\right.\)
=> R là Mg
c, \(\left\{{}\begin{matrix}n_{Fe}=0,1\left(mol\right)\\n_{Mg}=0,1\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,1.56=5,6\left(g\right)\\m_{Mg}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)
Quy hết kim loại R (II) và Fe về M (II):
\(n_{HCl}=0,2.2=0,4\left(mol\right)\)
PTHH: M + 2HCl ---> MCl2 + H2↑
0,2<-0,4------->0,2---->0,2
=> VH2 = 0,2.22,4 = 4,48 (l)
\(b,M_M=\dfrac{8}{0,2}=40\left(\dfrac{g}{mol}\right)\\ \rightarrow M_R=2.40-56=24\left(\dfrac{g}{mol}\right)\)
=> R là Mg
c, Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Mg}=b\left(mol\right)\end{matrix}\right.\left(a,b>0\right)\)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
a---->2a--------->a
Mg + 2HCl ---> MgCl2 + H2
b---->2b-------->b
=> hệ pt \(\left\{{}\begin{matrix}56a+24b=8\\2a+2b=0,4\end{matrix}\right.\Leftrightarrow a=b=0,1\left(mol\right)\left(TM\right)\)
=> \(\left\{{}\begin{matrix}m_{Fe}=0,1.56=5,6\left(g\right)\\m_{Mg}=0,1.24=2,4\left(g\right)\end{matrix}\right.\)
d, \(\left\{{}\begin{matrix}C_{M\left(FeCl_2\right)}=\dfrac{0,1}{0,2}=0,5M\\C_{M\left(MgCl_2\right)}=\dfrac{0,1}{0,2}=0,5M\end{matrix}\right.\)