
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 4 :
\(n_{Fe2O3}=\dfrac{24}{160}=0,15\left(mol\right)\)
Pt : \(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O|\)
1 3 1 3
0,15 0,15
a) \(n_{Fe2\left(SO4\right)3}=\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
⇒ \(m_{Fe2\left(SO4\right)3}=0,15.400=60\left(g\right)\)
b) \(C_{M_{Fe2\left(SO4\right)3}}=\dfrac{0,15}{0,5}=0,3\left(M\right)\)
Chúc bạn học tốt
a,\(n_{Fe_2O_3}=\dfrac{24}{160}=0,15\left(mol\right)\)
PTHH: Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Mol: 0,15 0,45 0,15
\(m_{Fe_2\left(SO_4\right)_3}=0,15.400=60\left(g\right)\)
b,\(C_{M_{ddFe_2\left(SO_4\right)_3}}=\dfrac{0,15}{0,5}=0,3\left(mol\right)\)


PTHH: Al2O3+6HCl➝2AlCl3+3H2O(1)
a)nAl2O3=\(\dfrac{10,2}{102}\)=0,1(mol)
mHCl=\(\dfrac{5\%.219}{100\%}\)=10,95(g)
⇒nHCl=\(\dfrac{10,95}{36,5}\)=0,3(mol)
Xét tỉ lệ Al2O3:\(\dfrac{0,1}{1}\)=0,1
Xét tỉ lệ HCl:\(\dfrac{0,3}{6}\)=0,05
⇒HCl pứng hết,Al2O3 còn dư
Theo PTHH(1) ta có nAl2O3 pứng=\(\dfrac{nHCl}{6}\)=\(\dfrac{0,3}{6}\)=0,05(mol)
⇒nAl2O3 dư=nAl2O3ban đầu-nAl2O3 pứng=0,1-0,05=0,05(mol)
⇒mAl2O3 dư=0,05.102=5,1(g)
b) C%HCl=\(\dfrac{0,3.36,5}{219+10,2}\).100%=4,8%
nAlCl3=0,1(mol)
⇒C%AlCl3=\(\dfrac{0,1.136,5}{10,2+219}\).100%=6%

Bài 7 :
Pt : ZnO + 2HCl → ZnCl2 + H2O\(|\)
1 2 1 1
a 2a
Fe2O3 + 6HCl → 2FeCl3 + 3H2O\(\)\(|\)
1 6 2 3
b 6b
Gọi a là số mol của ZnO
b là số mol của Fe2O3
Theo đề ta có : mZnO + mFe2O3 = 28,15 (g)
⇒ nZnO . MZnO + nFe2O3 . MFe2O3 = 28,15 g
⇒ 81a + 160b = 28,15 g (1)
Khối lượng của axit clohidric
C0/0HCl = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{6.547,5}{100}=32,85\left(g\right)\)
Số mol của axit clohidric
nHCl = \(\dfrac{m_{HCl}}{M_{HCl}}=\dfrac{32,85}{36,5}=0,9\left(mol\right)\)
⇒ 2a + 6b = 0,9 (2)
Từ (1),(2) , ta có hệ phương trình :
81a + 160b = 28,15
2a + 6b = 0,9
⇒ \(\left\{{}\begin{matrix}a=0,15\\b=0,1\end{matrix}\right.\)
Khối lượng của kẽm oxit
mZnO = nZnO . MZnO
= 0,15 . 81
= 12,15 (g)
Khối lượng của sắt (III) oxit
mFe2O3 = nFe2O3 . MFe2O3
= 0,1 . 160
= 16 (g)
0/0ZnO = \(\dfrac{m_{ZnO}.100}{m_{hh}}=\dfrac{12,15.100}{28,15}=43,16\)0/0
0/0Fe2O3 = \(\dfrac{m_{Fe2O3}.100}{m_{hh}}=\dfrac{16.100}{28,15}=56,84\)0/0
Chúc bạn học tốt

Bài 4 :
\(n_{H2}=\dfrac{V_{H2}}{22,4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Pt : \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2|\)
2 3 1 3
0,1 0,15 0,05 0,15
a) \(n_{Al}=\dfrac{0,15.2}{3}=0,1\left(mol\right)\)
⇒ \(m_{Al}=n_{Al}.M_{Al}\)
= 0,1 . 27
= 2,7 (g)
\(m_{Cu}=10-2,7=7,3\left(g\right)\)
0/0Al = \(\dfrac{m_{Al}.100}{m_{hh}}=\dfrac{2,7.100}{10}=27\)0/0
0/0Cu = \(\dfrac{m_{Cu}.100}{m_{hh}}=\dfrac{7,3.100}{10}=13\)0/0
b) \(n_{Al2\left(SO4\right)3}=\dfrac{0,15.1}{3}=0,05\left(mol\right)\)
⇒ \(m_{Al2\left(SO4\right)3}=n_{Al2\left(SO4\right)3.}M_{Al2\left(SO4\right)3}\)
= 0,05 . 342
= 17,1 (g)
\(n_{H2SO4}=\dfrac{0,1.3}{2}=0,15\left(mol\right)\)
⇒ \(m_{H2SO4}=n_{H2SO4}.M_{H2SO4}\)
= 0,15 .98
= 14,7 (g)
\(C_{H2SO4}=\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\)\(\dfrac{14,7.100}{15}=98\left(g\right)\)
mdung dịch sau phản ứng = (mAl + mCu) + mH2SO4 - mH2
= 10 + 98 - (0,15 . 2)
=107,7 (g)
\(C_{Al2\left(SO4\right)3}=\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{17,1.100}{107,7}=15,88\)0/0
Chúc bạn học tốt

Đổi 100ml = 0,1 lít
Ta có: \(n_{HCl}=2.0,1=0,2\left(mol\right)\)
a. PTHH: \(AgNO_3+HCl--->AgCl\downarrow+HNO_3\)
Theo PT: \(n_{AgNO_3}=n_{HCl}=0,2\left(mol\right)\)
Đổi 200ml = 0,2 lít
=> \(C_{M_{AgNO_3}}=\dfrac{0,2}{0,2}=1M\)
b. Ta có: \(m_{dd_{HNO_3}}=0,1\left(lít\right)\)
Theo PT: \(n_{HNO_3}=n_{HCl}=0,2\left(mol\right)\)
=> \(C_{M_{HNO_3}}=\dfrac{0,2}{0,1}=2M\)


PTHH: \(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
Ta có: \(\left\{{}\begin{matrix}m_{H_2SO_4}=588\cdot5\%=29,4\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{29,4}{98}=0,3\left(mol\right)\\n_{Al_2O_3}=\dfrac{20,4}{102}=0,2\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,3}{3}\) \(\Rightarrow\) Al2O3 còn dư
\(\Rightarrow n_{Al_2\left(SO_4\right)_3}=0,1\left(mol\right)=n_{Al_2O_3\left(dư\right)}\)
\(\Rightarrow C\%_{Al_2\left(SO_4\right)_3}=\dfrac{0,1\cdot342}{20,4+588-0,1\cdot102}\cdot100\%\approx5,72\%\)
 giúp mình với ạ
giúp mình với ạ giúp mình với ạ , mình đang cần gấp ạ, các bạn làm theo cách kẻ bảng ra giúp mình được không ạ
giúp mình với ạ , mình đang cần gấp ạ, các bạn làm theo cách kẻ bảng ra giúp mình được không ạ




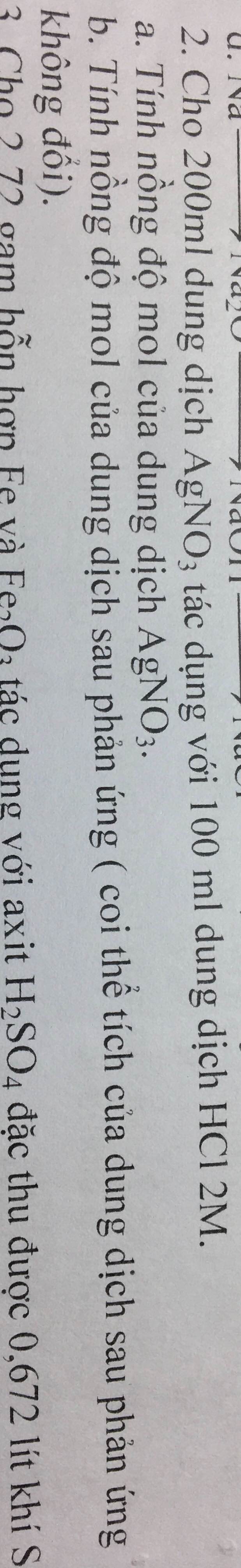
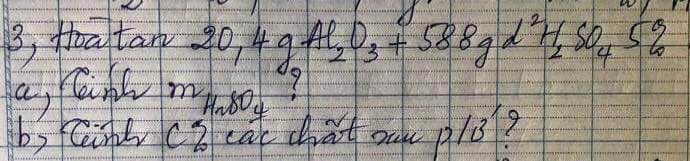
a, A2: O2
⇒ A1 = 158 (g/mol) → A1 là KMnO4
⇒ A4 = 12 (g/mol) → A4 là C
A3: H2O
⇒ A5 = 56 (g/mol) → A5 là Fe.
b, Vai trò của:
- H2O: Do Fe pư với O2 tạo hạt chất rắn nóng chảy nhiệt độ cao (Fe3O4), khi rơi xuống bình thủy tinh có thể làm nứt bình → dùng H2O để ngăn cách Fe3O4 rơi xuống với đáy bình thủy tinh.
- C: Pư giữa Fe và O2 cần nhiệt độ cao → C cháy trước tạo nhiệt độ cho pư xảy ra.