Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a) 2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O\)(Phản ứng oxi hóa-khử)
\(Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O\)
\(b) n_{SO_2} = \dfrac{672}{1000.22,4} = 0,03(mol)\\ n_{Fe}= \dfrac{2}{3}n_{SO_2} = 0,02(mol)\\ \%m_{Fe} = \dfrac{0,02.56}{2,72}.100\% = 41,18\%\\ \%m_{Fe_2O_3} = 100\% -41,18\% = 58,82\%\)

\(CuO+H_2SO_{4\left(đn\right)}\rightarrow CuSO_4+H_2O\)
0,04 0,04 (mol)
Cu+\(2H_2SO_{4\left(đn\right)}\rightarrow CuSO_4+SO_2+2H_2O\)
0,15 0,15 0,15 (mol)
n\(_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
phản ứng trên là phản ứng oxi hóa-khử[Cu:0\(\rightarrow\)+2(chất khử);\(H_2SO_4:+6\rightarrow+4\)(chất oxi hóa)]
n\(_{Cu}=0,15.64=9,6\left(g\right)\)
\(m_{CuO}=12,8-9,6=3,2\left(g\right)\)
\(\rightarrow\%m_{CuO}=\dfrac{3,2}{12,8}.100=25\%\)
\(n_{CuO}=\dfrac{3,2}{80}=0,04\left(mol\right)\)
\(\rightarrow\%m_{Cu}=\dfrac{9,6}{12,8}.100=75\%\)
\(m_{CuSO_4}=\left(0,15+0,04\right).160=30,4\left(g\right)\)

a, Ta có: $n_{O}=0,6(mol)$
Suy ra $n_{H^+/pu}=1,2(mol)\Rightarrow n_{H_2SO_4}=0,6(mol)$
Bảo toàn khối lượng ta có: $m_{muoi}=29,6+0,6.96=87,2(g)$

a)
$Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + H_2O$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
b) n Cu =a (mol) ; n Fe = b(mol)
=> 64a + 56b = 12(1)
n SO2 = a + 1,5b = 5,6/22,4 = 0,25(2)
(1)(2) suy ra a = b = 0,1
%m Cu = 0,1.64/12 .100% = 53,33%
%m Fe = 100% -53,33% = 46,67%
c)
n CuSO4 = a = 0,1(mol)
n Fe2(SO4)3 = 0,5a = 0,05(mol)
m muối = 0,1.160 + 0,05.400 = 36(gam)
d) n H2SO4 = 2n SO2 = 0,5(mol)
V H2SO4 = 0,5/2 = 0,25(lít)

PTHH: \(2Fe+6H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
a) Ta có: \(n_{SO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\) \(\Rightarrow n_{Fe}=\dfrac{1}{15}\left(mol\right)\)
\(\Rightarrow\%m_{Fe}=\dfrac{\dfrac{1}{15}\cdot56}{13,6}\cdot100\%\approx27,45\%\) \(\Rightarrow\%m_{CuO}=72,55\%\)
b) Ta có: \(m_{CuO}=13,6-\dfrac{1}{15}\cdot56\approx9,9\left(g\right)\) \(\Rightarrow n_{CuO}=n_{H_2SO_4}=\dfrac{9,9}{80}=0,12375\left(mol\right)\)
*Làm gì có H2SO4 loãng đâu nhỉ ??

nH2=4,48/22,4=0,2 mol
Fe +2HCl -->FeCl2+H2
0,2 0,2 mol
=>mFe=0,2*56=11,2 g
nSO2=10,08/22,4=0,45 mol
gọi số mol của Cu là a mol
bảo toàn e ta có
Cu\(^0\)-->Cu\(^{+2}\)+2e
a 2a S\(^{+6}\) + 2e -->S\(^{+4}\)
Fe\(^0\)--> Fe\(^{+3}\)+3e 0,45 0,9
0,2 0,6
=>a=0,15=>mCu=0,15*64=9,6 g
=>mhh=9,6+11,2=20,8g
=>%Cu=9,6*100/20,8=46,15%
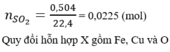
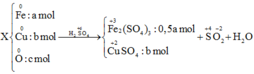
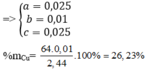
\(a)Cu + 2H_2SO_4 \to CuSO_4 + SO_2 + 2H_2O\\ \) (Phản ứng oxi hóa khử)
\(CuO + H_2SO_4 \to CuSO_4 + H_2O\\ b) n_{Cu} = n_{SO_2} = \dfrac{0,672}{22,4} = 0,03(mol)\\ \%m_{Cu} = \dfrac{0,03.64}{3,2}.100\% = 60\%\\ \%m_{CuO} = 100\%-60\% = 40\%\)