Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(n_{NO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Theo đề bài: \(108n_{Ag}+64n_{Cu}=2,36\) (1)
Bảo toàn electron: \(n_{Ag}+2n_{Cu}=n_{NO_2}=0,05\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Ag}=0,01\left(mol\right)\\n_{Cu}=0,02\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}\%m_{Ag}=\dfrac{108\cdot0,01}{2,36}\cdot100\%\approx45,76\%\\\%m_{Cu}=54,24\%\end{matrix}\right.\)
Ag + 2HNO3 ⟶ AgNO3 + H2O + NO2
Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O
\(n_{NO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Gọi x,y lần lượt là số mol Ag, Cu
Ta có : \(\left\{{}\begin{matrix}108x+64y=2,36\\x+2y=0,05\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,01\\y=0,02\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}m_{Ag}=0,01.108=1,08\left(g\right)\\m_{Cu}=0,02.64=1,28\left(g\right)\end{matrix}\right.\)
=> \(\%m_{Ag}=\dfrac{1,08}{2,36}.100=45,76\%\)
=>%mCu = 100 - 45,76 =54,24%

a)
Gọi $n_{Mg} = a ; n_{Al} = b \Rightarrow 24a + 27b = 9,9(1)$
$n_{NO} = 0,25(mol)$
Bảo toàn e: $2a + 3b = 0,25.3(2)$
Từ (1)(2) suy ra a = 0,525 ; b = -0,1<0
$\to$ Sai đề
3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O
Al + 4HNO3 → Al(NO3)3 + NO + 2H2O
Gọi x, y lần lượt là số mol Mg, Al
\(\left\{{}\begin{matrix}24x+27y=9,9\\\dfrac{2}{3}x+y=\dfrac{5,6}{22,4}\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,525\\y=-0,1\end{matrix}\right.\)
Bạn xem lại đề nhé!

\(n_{SO_2}=\dfrac{2,24}{22,4}=0,1mol\)
Gọi \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Cu}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}24x+64y=4,4\\BTe:2x+2y=2n_{SO_2}=2\cdot0,1=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,05\\y=0,05\end{matrix}\right.\)
\(m_{Mg}=0,05\cdot24=1,2g\)
\(m_{Cu}=0,05\cdot64=3,2g\)
\(n_{H_2SO_4}=2n_{Mg}+2n_{Cu}=2\cdot0,05+2\cdot0,05=0,2mol\)
\(m_{H_2SO_4}=0,2\cdot98=19,6g\)

a)
Gọi $n_{Mg} = a(mol) ; n_{Zn} = b(mol)$
Suy ra: $24a + 65b = 24,3(1)$
$n_{SO_2} = 0,5(mol)$
Bảo toàn electron : $2n_{Mg} + 2n_{Zn} = 2n_{SO_2}$
$\Rightarrow a + b = 0,5(2)$
Từ (1)(2) suy ra a = 0,2 ; b = 0,3
$m_{Mg} = 0,2.24 = 4,8(gam)$
$m_{Zn} = 0,3.65 = 19,5(gam)$
b)
Ta có :
$n_{H_2SO_4} = 2n_{SO_2} = 1(mol)$
$m_{H_2SO_4\ pư} = 1.98 = 98(gam)$

a) Gọi số mol Cu, Pb là a, b (mol)
=> 64a + 207b = 14,34 (1)
\(n_{NO}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
Cu0 - 2e --> Cu+2
a-->2a
Pb0 - 2e --> Pb+2
b-->2b
N+5 +3e --> N+2
0,18<--0,06
Bảo toàn e: 2a + 2b = 0,18 (2)
(1)(2) => a = 0,03; b = 0,06
=> \(\left\{{}\begin{matrix}\%m_{Cu}==\dfrac{0,03.64}{14,34}.100\%=13,39\%\\\%m_{Pb}=\dfrac{0,06.207}{14,34}.100\%=86,61\%\end{matrix}\right.\)
b)
\(\left\{{}\begin{matrix}n_{Cu\left(NO_3\right)_2}=0,03\left(mol\right)\\n_{Pb\left(NO_3\right)_2}=0,06\left(mol\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}m_{Cu\left(NO_3\right)_2}=0,03.188=5,64\left(g\right)\\m_{Pb\left(NO_3\right)_2}=0,06.331=19,86\left(g\right)\end{matrix}\right.\)

Đáp án C
Chất rắn Y gồm 2 kim loại là Cu và Fe.
Hòa tan hết Y trong HNO3 đặc nóng thu được 0,115 mol NO2.
Gọi số mol Cu và Fe trong Y lần lượt là a, b.
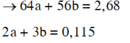
Giải được: a=0,02; b=0,025.
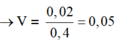
![]()
Gọi số mol Fe, Mg lần lượt là x, y
![]()
Dung dịch X chứa MgSO4 y mol và FeSO4 0,035-y mol(bảo toàn S).
Bảo toàn Fe:
![]()
Giải được: x=0,015; y=0,035.
Cho Ba(OH)2 tác dụng với X thu được kết tủa gồm BaSO4 0,035 mol và Mg(OH)20,035 mol.
Vậy nung kết tủa được rắn nặng m=9,555 gam gồm BaSO4 và MgO

\(3,68g\left\{{}\begin{matrix}Fe\\Mg\end{matrix}\right.+HNO3->\left\{{}\begin{matrix}Fe\left(NO3\right)3\\Mg\left(NO3\right)2\end{matrix}\right.+5,376\left(l\right)NO2\)
Bảo toàn e :
\(3x+2y=0,24\)
Ta có :
\(\left\{{}\begin{matrix}56x+24y=3,68\\3x+2y=0,24\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,04\left(mol\right)\\y=0,06\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%mFe=\dfrac{0,04.56}{3,68}=60,87\%\\\%mMg=\dfrac{0,06.24}{3,68}=39,13\%\end{matrix}\right.\)
Bảo toàn nguyên tố Fe và Mg :
\(nFe=nFe\left(NO3\right)3=0,04\left(mol\right)\)
\(nMg=nMg\left(NO3\right)2=0,06\left(mol\right)\)
Ta có : \(nHNO3pu=0,04.3+0,06.2=0,24\left(mol\right)\)
\(\Rightarrow mHNO3=0,24.63=15,12\left(g\right)\)

Chọn đáp án C
+ Ta có: nHNO3 = 2nO/Oxit + 4nNO
⇔ nHNO3 pứ =
![]()
⇒ Chọn C


a)
Gọi $n_{Al} = a ; n_{Fe} = b$
$\Rightarrow 27a + 56b = 12,55(1)$
$n_{NO_2} = 0,75(mol)$
Bảo toàn electron :
$3n_{Al} + 3n_{Fe} = n_{NO_2} \Rightarrow 3a + 3b = 0,75(2)$
Từ (1)(2) suy ra a = 0,05 ; b = 0,2
$m_{Al} = 0,05.27 = 1,35(gam)$
$m_{Fe} = 0,2.56 = 11,2(gam)$
b)
$n_{HNO_3} = 2n_{NO_2} = 0,75.2 = 1,5(mol)$