Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
nFe3+ = 0,08 (mol); H+ còn dư
Dd Y gồm: FeCl3 , FeCl2, CuCl2, HCl dư
Qúa trình điện phân dd Y
Catôt (Fe3+, Fe2+, Cu2+, H+) Anốt (Cl-)
Fe3+ +1e → Fe2+ 2Cl- + 2e → Cl2
0,08 → 0,08
Cu 2+ + 2e → Cu
x → 2x
2H+ + 2e → H2
Khi catốt có khí thì ngừng => chưa xảy ra phản ứng điện phân H+
Gọi nCuCl2 = x (mol)
=> ne trao đổi = 0,08 + 2x = 2nCl2
mdd giảm = mCu + mCl2 = 64x + 71( 0,04 + x) = 13,64
=> x = 0,08 (mol)
Gọi số mol Fe3O4 và Fe2O3 lần lượt là a và b mol
BTKL: 232a + 160b + 0,08.64 = 27,2 (1)
2Fe3+ + Cu → Fe2+ + Cu2+
=> nFe3+ sau = nFe3+ ban đầu – nCu
<=> 2a + 2b – 2.0,08 = 0,08 (2)
Từ (1) và (2) => a = 0,04 ; b = 0,08 mol
BTNT Fe: nFe2+ = nFe bđ – nFe3+ sau = 0,2 mol
nH+ dư = nHCl dư = nHCl bđ – 3nFeCl3 – 2nFeCl2 – 2nCuCl2 = 0,1 mol
Sau điện phân thì nFe2+ = 0,28 (mol); nCl- = 0,66 (mol); nH+ = 0,1 (mol)
Khi cho AgNO3 vào:
3Fe2+ + 4H+ + NO3- →3Fe3+ + NO + H2O
0,075← 0,1
Ag+ + Fe2+ → Fe3+ + Ag↓
(0,28 – 0,075)→ 0,205
Ag+ + Cl- → AgCl↓
0,66 → 0,66
m↓ = mAg + mAgCl = 0,205.108 + 0,66.143,5 = 116,85(g)

Chọn B.
Dung dịch X chứa H+(x mol), Fe2+ (y mol), Fe3+ (z mol), Cu2+ (t mol), Cl- (0,6 mol)
![]()
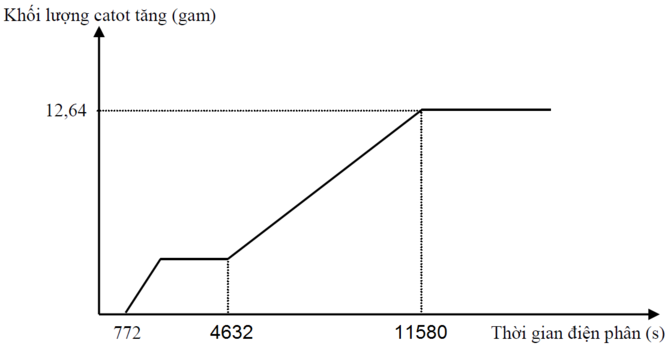
Tại thời điểm t1 = 772 (s): Fe3+ điện phân hết chuyển thành Fe2+ Þ ne (1) = z
Tại thời điểm t2 = 4632 (s): Cu2+, H+ điện phân hết Þ ne (2) = x + z + 2t
Tại thời điểm t3 = 11580 (s): Fe2+ điện phân hết Þ ne (3) = x + 2y + 3z + 2t và 56(y + z) + 64t = 12,64 (2)
+ Với t2 = 6t1 Þ x + z + 2t = 6z (3)
+ Với t3 = 15t1 Þ x + 2y + 3z + 2t = 15z. Thay (1) vào Þ z = 0,04
Từ (1), (2), (3) suy ra: x = 0,12 ; y = 0,14 ; t = 0,04
Khi cho AgNO3 đến dư vào X thì:
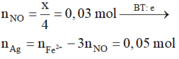
Kết tủa thu được là AgCl (0,6 mol) và Ag (0,03 mol) Þ m = 91,5 (g)

Đáp án B
Do dung dịch Y tăng 21,28 gam.
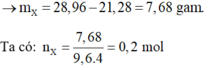
Do vậy ta giải được số mol CO2 và NO trong X lần lượt là 0,06 mol và 0,08 mol.
Vậy số mol FeCO3 là 0,06 mol.
Do khi thêm AgNO3 vào Y có xuất hiện NO nên H+ dư nên Y không có NO3- dư.
Bảo toàn N:
![]()
Gọi a,b lần lượt là số mol Mg, Fe3O4, c là số mol HCl.
Do vậy kết tủa chứa AgCl c mol và Ag.
![]()
Do cho AgNO3 vào sinh ra 0,03 mol NO nên H+ dư 0,12 mol.
Bảo toàn e kết hợp bảo toàn điện tích:
c = 0,04 + 8b + 0,06.2 + 0,08.3 + 0,06.8 + 0,04.8 + 0,12
Bảo toàn e:
![]()
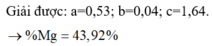

Chọn D.
Đặt số mol NaCl ban đầu lần lượt là x mol.
Khí thoát ra tại catot gồm Cl2 (0,5x mol) và O2 (0,51 – 0,5x mol)
Dung dịch Y lúc này chứa HNO3 và NaNO3.
Cho Y tác dụng tối đa với Fe (Fe lên Fe2+)


Đáp án B
Ta có sơ đồ phản ứng:
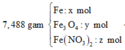
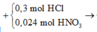

* Y + AgNO3
Bảo toàn nguyên tố Cl:
![]()
![]()
![]()
Fe2+ →Fe3+ + 1e
4H+ + NO−3 + 3e → NO + H2O
0,036 ← 0,027 ← 0,009
Ag+ + 1e → Ag
0,009 ← 0,009
Bảo toàn electron ta có: n F e 2 + = 0,027 + 0,009 = 0,036 mol
Dung dịch Y gồm: Fe2+ : 0,036 mol, H+ : 0,036 mol, Cl− : 0,3 mol, Fe3+
Bảo toàn điện tích ta có:
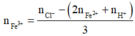
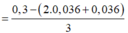
= 0,064 mol
* X + HNO3
n H + p h ả n ứ n g = 0,3 + 0,024 - 0,036 = 0,288 mol
![]()
Bảo toàn nguyên tố oxi ta có: 4b + 6c + 0,024.3 + 0,144 => 2b + 3c = 0,052 (1)
Ta có hệ phương trình:
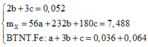
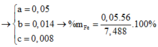
= 37,4 %.


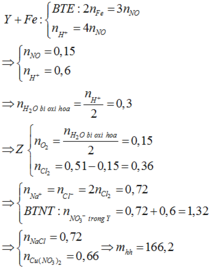

Quy hỗn hợp thành Fe2O3, FeO và CuO với số mol lần lượt là a b và c.
Ta có sơ đồ phản ứng:
Khi điện phân dung dịch Y đến khi catot thoát khí ⇒ FeCl3 và CuCl2 đã bị điện phân hết.
⇒ mGiảm = nFeCl3×35,5 + nCuCl2×135 = 13,64 gam Û nCuCl2 = 0,08 mol.
●Tóm lại sau điện phân dung dịch chứa: nFeCl2 = 0,28 mol và nHCl = 0,1 mol.
Cho dung dịch sau điện phân + AgNO3 ⇒ 3Fe2+ + 4H+ + NO3– → Fe3+ + NO + 2H2O.
⇒ nFe2+ bị mất đi = 0,1 × 3 ÷ 4 = 0,075 mol
⇒ nFe2+ còn lại = 0,28 – 0,075 = 0,205 mol.
⇒ nAg = nFe2+ = 0,205 mol
nAgCl = nCl– = 0,28×2 + 0,1 = mol.
⇒ m↓ = mAg + mAgCl = 0,205×108 + 0,66×143,5 = 116,85
Đáp án A