Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
![]()
![]()
=> Axit là HNO3
Dd Z chứa Al3+ và có thể có NH4+
NaOH + dd Z tạo ra dd trong suốt => NaOH hòa tan muối Al3+ thành AlO2-
nOH- = 4nAl3+ + nNH4+ => nNH4+ = 1,45 – 4.0,34 = 0,09 (mol)
Gọi k là số electron N+5 nhận để tạo ra khí Y
BT e: ne (Al nhường) = ne (N+5 nhận)
=> 0,34.3 = 0,03k + 0,09.8
=> k = 10
=> Y là N2
Áp dụng CT nhanh: nHNO3 = 12nN2 + 10nNH4+ = 12.0,03+ 10.0,09 = 1,26 (mol)
=> VHNO3 = 1,26.22,4 = 5,04 (lít)
Đáp án B

Đáp án D
Đặt nNH4NO3 = x ||⇒ ∑nNO3/muối KL = ne = (8x + 0,3) mol.
||⇒ mmuối = mKL + mNO3/muối KL + mNH4NO3 = 7,5 + 62 × (8x + 0,3) + 80x = 54,9(g).
⇒ x = 0,05 mol ⇒ nHNO3 = 10nNH4NO3 + 12nN2 = 0,86 mol ⇒ V = 0,86 lít

Đáp án D
Đặt nNH4NO3 = x ||
⇒ ∑nNO3/muối KL = ne = (8x + 0,3) mol.
||⇒ mmuối = mKL + mNO3/muối KL + mNH4NO3
= 7,5 + 62 × (8x + 0,3) + 80x = 54,9(g).
⇒ x = 0,05 mol ⇒ nHNO3 = 10nNH4NO3 + 12nN2 = 0,86 mol
⇒ V = 0,86 lít

Chọn đáp án B
nAl = 0,02 mol; nZn = 0,05 mol; nNaOH = 0,485 mol.
NaOH + Y → dung dịch trong suốt {NaAlO2, Na2ZnO2, NaNO3}
Bảo toàn nguyên tố Natri: nNO3–/Y = nNaNO3 = 0,365 mol.
► Hòa tan "hoàn toàn" ⇒ HNO3 dư hoặc đủ, kim loại hết.
Đặt nNH4+ = x; nN2 = y. Bảo toàn electron:
8x + 10y = 0,02 × 3 + 0,05 × 2. Bảo toàn nguyên tố Nitơ:
∑nN/spk = 0,394 - 0,365 = x + 2y || Giải hệ có:
⇒ x = 0,005 mol; y = 0,012 mol ⇒ V = 268,8 ml ⇒ chọn B.

Đáp án B.
![]()
Giả sử Z + H2SO4 → dung dịch muối tạo thành chỉ có Fe2(SO4)3:
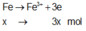
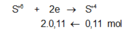
![]()
![]()
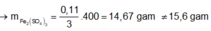
→ muối thu được gồm FeSO4 và Fe2(SO4)3.
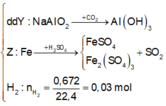
Ta có sơ đồ phản ứng:
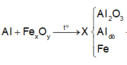
→ + N a O H d ư

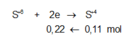
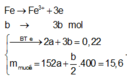
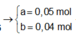
![]()
X tác dụng được với dung dịch NaOH tạo khí H2 →Al dư.
![]()
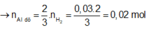
![]()
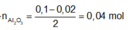
![]()
![]()
![]()
![]()

Đáp án D
- Hướng tư duy 1: Bảo toàn nguyên tố N
- Quá trình:


![]()
+ Ta có
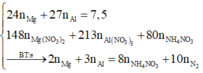
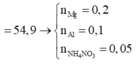
![]()
![]()
- Hướng tư duy 2: Tính theo số mol HNO3
+ Ta có
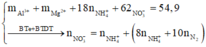
![]()
![]()
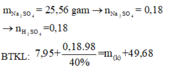
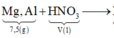
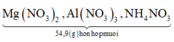
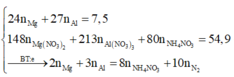
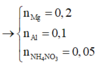

Đáp án B
=> Axit là HNO3
Dd Z chứa Al3+ và có thể có NH4+
NaOH + dd Z tạo ra dd trong suốt
=> NaOH hòa tan muối Al3+ thành AlO2-
nOH- = 4nAl3+ + nNH4+
=> nNH4+ = 1,45 – 4.0,34 = 0,09 (mol)
Gọi k là số electron N+5 nhận để tạo ra khí Y
BT e: ne (Al nhường) = ne (N+5 nhận)
=> 0,34.3 = 0,03k + 0,09.8
=> k = 10
=> Y là N2