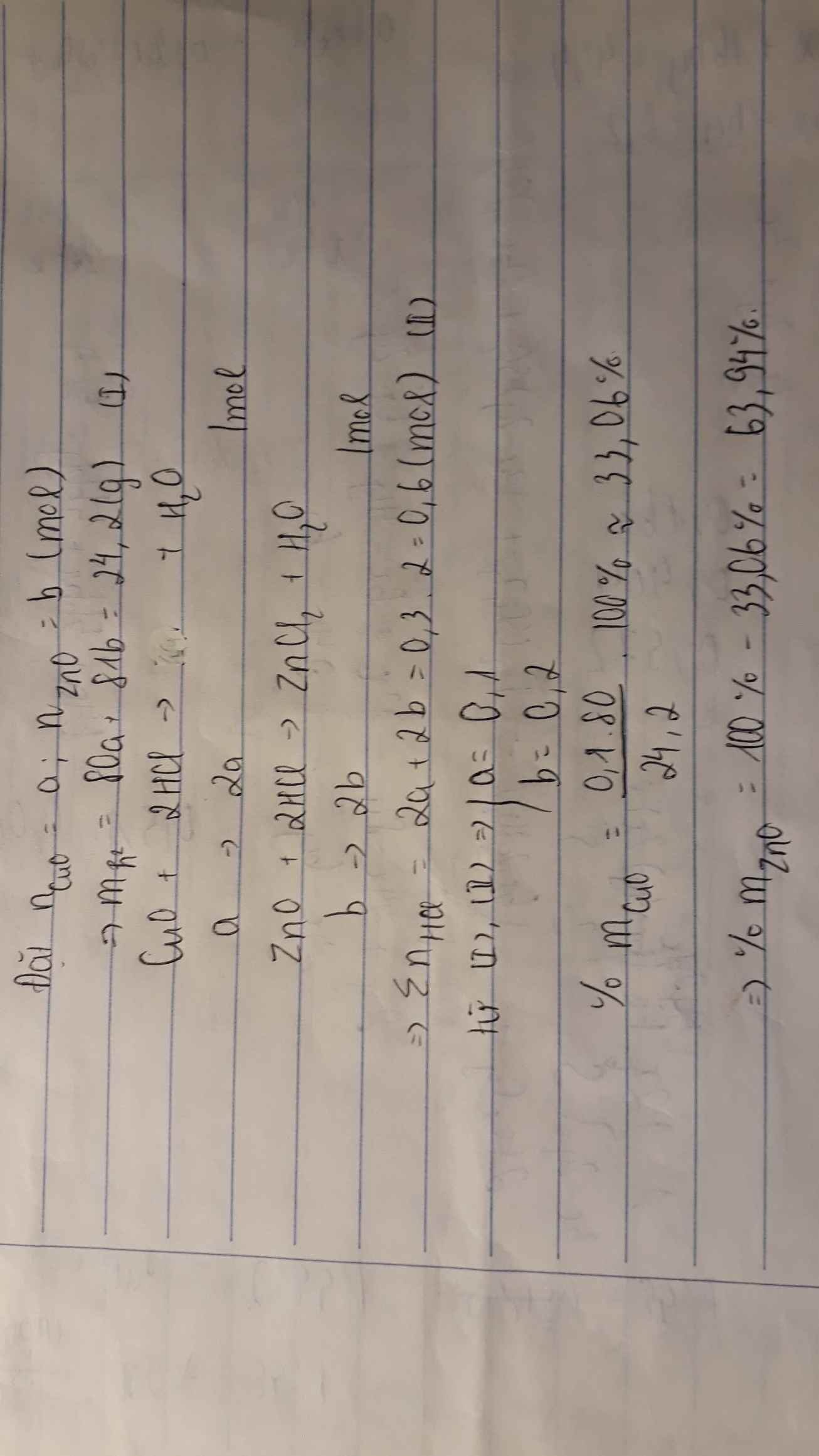Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a)n_{HCl}=0,1.3=0,3mol\\ n_{CuO}=a;n_{ZnO}=b\\ CuO+2HCl\rightarrow CuCl_2+H_2O\\ ZnO+2HCl\rightarrow ZnCl_2+H_2O\\ \Rightarrow\left[{}\begin{matrix}80a+81b=12,1\\2a+2b=0,3\end{matrix}\right.\\ \Rightarrow a=0,05;b=0,1\\ \%m_{CuO}=\dfrac{80.0,05}{12,1}\cdot100=33,06\%\\ \%m_{ZnO}=100-33,06=66,94\%\\ b)ZnO+H_2SO_4\rightarrow ZnSO_4+H_2O\\ CuO+H_2SO_4\rightarrow CuSO_4+H_2O \\ n_{H_2SO_4}=0,05+0,1=0,15mol\\ m_{ddH_2SO_4}=\dfrac{0,15.98}{20}\cdot100=73,5g\)

200 ml =0,2 l
nHCl=0,2.3=0,6(mol)
CuO+2HCl−>CuCl2+H2O(1)
a 2a (mol)
ZnO+2HCl−>ZnCl2+H2O(2)
b 2b (mol)
ta có
{80a+81b=24,2
2a+2b=0,6{
giả ra ta được a =0,1 (mol)
=> mCuO=0,1.80=8(g)
thành phần % theo khối lượng mỗi oxit trong hỗn hợp ban đầu là
%CuO = 824,2.100%=33,06%
%ZnO= 100% - 33,06% = 66,94%

Pt : CuO + 2HCl → CuCl2 + H2O\(|\)
1 2 1 1
a 2a
ZnO + 2HCl → ZnCl2 + H2O\(|\)
1 2 1 1
b 2b
a) Gọi a là số mol của CuO
b là số mol của ZnO
Theo đề ta có : mCuO + mZnO = 12,1 (g)
⇒ nCuO . MCuO + nZnO . MZnO = 12,1 g
80a + 81b = 12,1g (1)
100ml= 0,1l
Số mol của dung dịch axit clohidric
CMHCl = \(\dfrac{n}{V}\Rightarrow n=C_M.V=3.0,1=0,3\left(mol\right)\)
⇒ 2a + 2b = 0,3 (2)
Từ (1),(2) ta có hệ phương trình :
80a + 81b = 12,1
2a + 2b = 0,3
⇒ \(\left\{{}\begin{matrix}a=0,05\\b=0,1\end{matrix}\right.\)
Khối lượng của đồng (II) oxit
mCuO = nCuO . MCuO
= 0,05 . 80
= 4 (g)
Khối lượng của kẽm oxit
mZnO = nZnO . MZnO
= 0,1. 81
= 8,1 (g)
0/0CuO = \(\dfrac{m_{CnO}.100}{m_{hh}}=\dfrac{4.100}{12,1}=33,06\)0/0
0/0ZnO = \(\dfrac{m_{ZnO}.100}{m_{hh}}=\dfrac{8,1.100}{12,1}=66,94\)0/0
b) Pt : CuO + H2SO4 → CuSO4 + H2O\(|\)
1 1 1 1
0,05 0,05
ZnO + H2SO4 → ZnSO4 + H2O\(|\)
1 1 1 1
0,1 0,1
Số mol tổng của axit sunfuric
nH2SO4 = 0,05 + 0,1
= 0,15 (mol)
Khối lượng của axit sunfuric
mH2SO4 = nH2SO4 . MH2SO4
= 0,15 . 98
= 14,7 (g)
Khối lượng của dung dịch axit sunfuirc cần dùng
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{14,7.100}{20}=73,5\left(g\right)\)
Chúc bạn học tốt
Gọi x,y lần lượt là số mol của CuO và ZnO
Số mol HCl
N=Cm×V= 3×0,1=0,3mol
Lập PTHH
CuO + 2HCl --> CuCl2 + H2O
x-->2x
ZnO + 2HCl --> ZnCl2 + H2O
y--> 2y
Theo PTPƯ ta có
2x+2y=0.3 (1)
Theo đề bài ta có
mCuO+mZnO =80x + 81y= 12,1g (2)
Từ (1),(2) =>
80x+81y=12,1g=>x=0.05 mol
2x+2y=0,3=>y=0,1mol
a) %CuO=0,05×80×100/12,1=33,06%
%ZnO=0,1×80×100/12,1=66,94%
b)CuO+H2SO4-->CuSO4 +H2O
0,05---> 0,05
ZnO+H2SO4-->ZnSO4+H2O
0,1--->0,1
nH2SO4=0,05+0,1=0,15mol
mH2SO4=0,15×98=14,7g
mddH2SO4 =14,7:20=73,5g
Có j sai đừng trách nha

nếu bn đoạn trên bn hiểu rồi thì thôi nhe
Ta có: \(\left\{{}\begin{matrix}80x+81y=12,1\\2x+2y=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}80x+81y=12,1\\80x+80y=12\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}y=0,1\\2x+2y=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}y=0,1\\x=0,05\end{matrix}\right.\)
Giống như giải hệ phương trình thôi bn
a,\(n_{HCl}=0,1.3=0,3\left(mol\right)\)
PTHH: CuO + 2HCl → CuCl2 + H2O
Mol: x 2x
PTHH: ZnO + 2HCl → ZnCl2 + H2O
Mol: y 2y
Ta có: \(\left\{{}\begin{matrix}80x+81y=12,1\\2x+2y=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,05\\y=0,1\end{matrix}\right.\)
\(m_{CuO}=0,05.80=4\left(g\right);m_{ZnO}=12,1-4=8,1\left(g\right)\)
c,
PTHH: CuO + H2SO4 → CuSO4 + H2O
Mol: 0,05 0,05
PTHH: ZnO + H2SO4 → ZnSO4 + H2O
Mol: 0,1 0,1
\(m_{ddH_2SO_4}=\dfrac{\left(0,05+0,1\right).98.100}{20}=73,5\left(g\right)\)

a)
$CuO + H_2SO_4 \to CuSO_4 + H_2O$
$ZnO + H_2SO_4 \to ZnSO_4 +H_2O$
b) Gọi $n_{CuO} = a(mol) ; n_{ZnO} = b(mol) \Rightarrow 80a +81b = 12,1(1)$
Theo PTHH :
$n_{H_2SO_4} = a + b = \dfrac{73,5.20\%}{98} = 0,15(mol)(2)$
Từ (1)(2) suy ra : a = 0,05 ; b = 0,1
$\%m_{CuO} = \dfrac{0,05.80}{12,1}.100\% = 33,06\%$
$\%m_{ZnO} = 100\% - 33,06\% = 66,94\%$

Đổi 300ml = 0,3 lít
Ta có: \(n_{HCl}=2.0,3=0,6\left(mol\right)\)
a. PTHH:
CuO + 2HCl ---> CuCl2 + H2O (1)
ZnO + 2HCl ---> ZnCl2 + H2O (2)
b. Gọi x, y lần lượt là số mol của CuO và ZnO
Theo PT(1): \(n_{HCl}=2.n_{CuO}=2x\left(mol\right)\)
Theo PT(2): \(n_{HCl}=2.n_{ZnO}=2y\left(mol\right)\)
=> 2x + 2y = 0,6 (*)
Theo đề, ta có: 80x + 81y = 24,2 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}2x+2y=0,6\\80x+81y=24,2\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
=> \(m_{CuO}=0,1.80=8\left(g\right)\)
=> \(\%_{m_{CuO}}=\dfrac{8}{24,2}.100\%=33,06\%\)
\(\%_{m_{Zn}}=100\%-33,06\%=66,94\%\)
c. PTHH:
CuO + H2SO4 ---> CuSO4 + H2O (3)
ZnO + H2SO4 ---> ZnSO4 + H2O (4)
Theo PT(3): \(n_{H_2SO_4}=n_{CuO}=0,1\left(mol\right)\)
Theo PT(4): \(n_{H_2SO_4}=n_{ZnO}=0,2\left(mol\right)\)
=> \(n_{H_2SO_4}=0,1+0,2=0,3\left(mol\right)\)
=> \(m_{H_2SO_4}=0,3.98=29,4\left(g\right)\)
Ta có: \(C_{\%_{H_2SO_4}}=\dfrac{29,4}{m_{dd_{H_2SO_4}}}.100\%=20\%\)
=> \(m_{dd_{H_2SO_4}}=147\left(g\right)\)

CuO +2HCl= CuCl2 +H2O
ZnO+2HCl= ZnCl2 +H2O
gọi x,y là mol của CuO, ZnO
80x + 81y = 12.1
2x+2y = 0.3
=> x=0.05 , y=0.1 => mCuO= 4 %CuO=4/12.1 m ZnO=8.1 =>%ZnO=8.1/12.1
nH2SO4=1/2nHCl=0.3/2 =0.15
mH2SO4=0.15x98=14.7g => mddH2SO4=14.7/20%=73.5g