Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

$NaOH + HCl \to NaCl + H_2O$
$n_{HCl\ dư} = n_{NaOH} = 0,05.2 = 0,1(mol)$
Gọi $n_{Fe} = a ; n_{Zn} = b \Rightarrow 56a + 65b = 12,1(1)$
$Fe + 2HCl \to FeCl_2 + H_2$
$Zn + 2HCl \to ZnCl_2 + H_2$
$n_{HCl} = 2a + 2b = 0,5 -0,1 = 0,4(2)$
Từ (1)(2) suy ra a = b = 0,1
$\%m_{Fe} = \dfrac{0,1.56}{12,1}.100\% = 46,28\%$
$\%m_{Zn} = 100\% -46,28\% = 53,72\%$
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(HCl_{dư}+NaOH\rightarrow NaCl+H_2O\)
Gọi x, y lần lượt là số mol Fe, Zn, theo đề ta có:
\(\left\{{}\begin{matrix}56x+65y=12,1\\2x+2y=0,5.1-0,05.2\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
=> \(\%m_{Fe}=\dfrac{0,1.56}{12,1}=46,28\%\)
=> \(\%m_{Zn}=100-46,28=53,72\%\)

\(n_{H2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
a) Pt : \(2Al+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2|\)
2 2 2 2 3
0,2 0,2 0,3
\(Al_2O_3+2NaOH\rightarrow2NaAlO_2+H_2O|\)
1 2 2 1
0,1 0,2
b) \(n_{Al}=\dfrac{0,3.2}{3}=0,2\left(mol\right)\)
\(m_{Al}=0,2.27=5,4\left(g\right)\)
\(m_{Al2O3}=15,6-5,4=10,2\left(g\right)\)
c) Có : \(m_{Al2O3}=10,2\left(g\right)\)
\(n_{Al2O3}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
\(n_{NaOH\left(tổng\right)}=0,2+0,2=0,4\left(mol\right)\)
\(V_{ddNaOH}=\dfrac{0,4}{1}=0,4\left(l\right)=400\left(ml\right)\)
Chúc bạn học tốt

a) \(m_{HCl}=200.10,95\%=21,9\left(g\right)\)
b) \(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
x_______2x________x____x(mol)
\(n_{HCl}=\dfrac{200.10,95\%}{36,5}=0,6\left(mol\right)\)
Dung dịch A phải có HCl dư mới có thể trung hòa được NaOH.
\(n_{NaOH}=0,05.2=0,1\left(mol\right)\)
\(NaOH+HCl\rightarrow NaCl+H_2O\)
y________y______y(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}2x+y=0,6\\y=0,1\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,25\\y=0,1\end{matrix}\right.\)
\(\Rightarrow a=m_{CaCO_3}=100x=100.0,25=25\left(g\right)\\ V=V_{CO_2\left(đktc\right)}=22,4x=22,4.0,25=5,6\left(l\right)\)
c)
\(m_{ddA}=25+200-0,25.44=214\left(g\right)\\ C\%_{ddCaCl_2}=\dfrac{0,25.111}{214}.100\approx12,967\%\\ C\%_{ddHCl\left(dư\right)}=\dfrac{0,1.36,5}{214}.100\approx1,706\%\)

\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Gọi x, y lần lượt là số mol Al, Fe
Theo đề bài ta có hệ pt
\(\left\{{}\begin{matrix}27x+56y=8,3\\\dfrac{3}{2}x+y=\dfrac{5,6}{22,4}=0,25\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
a)\(x=\dfrac{\dfrac{0,1.3}{2}+0,1}{0,2}=0,25M\)
b)\(\%m_{Al_2(SO_4)_3}=\dfrac{\dfrac{0,1}{2}.342}{\dfrac{0,1}{2}.342+0,1.152}.100=52,94\%\)
=> %mFeSO4=100-52,94=47,06%
c)\(CM_{Al_2(SO_4)_3}=\dfrac{0,05}{0,2}=0,25M\)
\(CM_{FeSO_4}=\dfrac{0,1}{0,2}=0,5M\)
d) 1> Thu được kết tủa bé nhất
-TH1 : Lượng KOH chỉ phản ứng với FeSO4 tạo kết tủa, không đủ để tạo kết tủa với Al2(SO4)3
\(2KOH+FeSO_4\rightarrow Fe\left(OH\right)_2+K_2SO_4\)
=> \(m_{ddKOH}=\dfrac{0,1.2.56}{15\%}=74,67\left(g\right)\)
TH2: Lượng KOH phản ứng với FeSO4 tạo kết tủa và tạo kết tủa với Al2(SO4)3 sau đó tan kết tủa của Al2(SO4)3
\(2KOH+FeSO_4\rightarrow K_2SO_4+Fe\left(OH\right)_2\)
\(6KOH+Al_2(SO_4)_3\rightarrow2Al\left(OH\right)_3+3K_2SO_4\)
\(Al\left(OH\right)_3+KOH\rightarrow KAlO_2+2H_2O\)
=>\(m_{ddKOH}=\dfrac{\left(0.1.2+0,05.6+0,1\right).56}{15\%}=224\left(g\right)\)
2> Thu được kết tủa lớn nhất :
Lượng KOH phản ứng với FeSO4 tạo kết tủa và tạo kết tủa với Al2(SO4)3 và không tan kết tủa của Al2(SO4)3
\(2KOH+FeSO_4\rightarrow K_2SO_4+Fe\left(OH\right)_2\)
\(6KOH+Al_2(SO_4)_3\rightarrow2Al\left(OH\right)_3+3K_2SO_4\)
=>\(m_{ddKOH}=\dfrac{\left(0.1.2+0,05.6\right).56}{15\%}=186,67\left(g\right)\)
Đặt \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\)
\(PTHH:2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(\left(mol\right)\) \(a\) \(1,5a\) \(0,5a\) \(1,5a\)
\(PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(\left(mol\right)\) \(b\) \(b\) \(b\) \(b\)
Ta có hpt: \(\left\{{}\begin{matrix}27a+56b=8,3\\1,5a+b=\dfrac{5,6}{22,4}\end{matrix}\right.\Leftrightarrow a=b=0,1\left(mol\right)\)
\(a.x=\dfrac{1,5a+b}{0,2}=\dfrac{0,15+0,1}{0,2}=1,25\left(M\right)\\ b.\%m_{Al}=\dfrac{27.0,1}{8,3}.100=32,53\left(\%\right)\\ \%m_{Fe}=100-32,53=67,47\left(\%\right)\\ c.C_{M_{Al_2\left(SO_4\right)_3}}=\dfrac{0,5a}{0,2}=0,25\left(M\right)\\ C_{M_{FeSO_4}}=\dfrac{b}{0,2}=0,5\left(M\right)\\ d.\)
\(PTHH:Al_2\left(SO_4\right)_3+6KOH\rightarrow3K_2SO_4+2Al\left(OH\right)_3\)
\(\left(mol\right)\) \(0,05\) \(0,3\) \(0,1\)
\(PTHH:FeSO_4+2KOH\rightarrow Fe\left(OH\right)_2+K_2SO_4\)
\(\left(mol\right)\) \(0,1\) \(0,2\)
\(PTHH:Al\left(OH\right)_3+KOH\rightarrow KAlO_2+2H_2O\)
\(\left(mol\right)\) \(0,1\) \(0,1\)
\(d.1.\) Lượng kết tủa bé nhất khi kết tủa \(Al\left(OH\right)_3\) sinh ra tan hết trong dd KOH
Khi đó: \(n_{KOH}=0,6\left(mol\right)\rightarrow m_{ddKOH}=\dfrac{0,6.100.56}{15}=224\left(g\right)\)
\(d.2.\) Lượng kết tủa lớn nhất khi KOH tác dụng vừa đủ với dd A
Khi đó: \(n_{KOH}=0,5\left(mol\right)\rightarrow m_{ddKOH}=\dfrac{0,5.56.100}{15}=186,67\left(g\right)\)
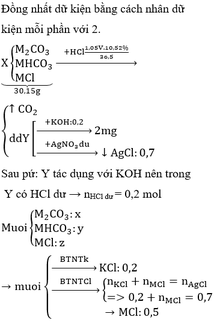
a, gọi a= nFe
b= nFeO
=> 56a + 72b= 12,8 (1)
Fe +H2SO4 -> FeSO4 +H2
a b b a
FeO +H2SO4 -> FeSO4 +H2O
b b b
a=nH2 = 2,24/22,4= 0,1 mol
từ (1) => b= 0,1
mFe= 56.0,1=5,6(g)
m FeO = 72.0,1= 7,2(g)
b, nH2SO4 (bđ) = 0,25 mol
nH2SO4 pứ = a+b =0,2 mol
=> nH2SO4 dư = 0,25-0,2=0,05 mol
2NaOH +H2SO4 -> Na2SO4 +2H2O
0,1 0,05
V(NaOH)= 0,1/ 1= 0,1 lit =100ml
E tham khảo! Anh nãy làm tại câu hỏi bấm lộn xóa