Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Đặt:n_{Al}=a\left(mol\right),n_{Fe}=b\left(mol\right)\)
\(m_{hh}=27a+56b=8.3\left(g\right)\left(1\right)\)
\(n_{H_2}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Tathấy:\)
\(n_{HCl}=2n_{H_2}=2\cdot0.25=0.5\left(mol\right)\)
\(V_{ddHCl}=\dfrac{0.5}{0.2}=2.5\left(l\right)\)
\(n_{H_2}=1.5a+b=0.25\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=b=0.1\)
\(C_{M_{AlCl_3}}=\dfrac{0.1}{2.5}=0.04\left(M\right)\)
\(C_{M_{FeCl_2}}=\dfrac{0.1}{2.5}=0.04\left(M\right)\)
Chúc em học tốt !!!
a, Ta có: \(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
BTNT H, có: \(n_{HCl}=2n_{H_2}=0,5\left(mol\right)\)
\(\Rightarrow V_{HCl}=\dfrac{0,5}{0,2}=2,5\left(l\right)\)
b, Giả sử: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
⇒ 27x + 56y = 8,3 (1)
Các quá trình:
\(Al^0\rightarrow Al^{+3}+3e\)
x___________ 3x (mol)
\(Fe^0\rightarrow Fe^{+2}+2e\)
y____________2y (mol)
\(2H^++2e\rightarrow H_2^0\)
______0,5__0,25 (mol)
Theo ĐLBT mol e, có: 3x + 2y = 0,5 (2)
Từ (1) và (2) ⇒ x = y = 0,1 (mol)
BTNT Al và Fe, có: \(\left\{{}\begin{matrix}n_{AlCl_3}=n_{Al}=0,1\left(mol\right)\\n_{FeCl_3}=n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow C_{M_{AlCl_3}}=C_{M_{FeCl_3}}=\dfrac{0,1}{2,5}=0,04M\)
Bạn tham khảo nhé!

\(2Al+6HCl->2AlCl_3+3H_2\\ Fe+2HCl->FeCl_2+H_2\\ n_{Al}=a;n_{Fe}=b\\ 27a+56b=8,3\\ 1,5a+b=\dfrac{5,6}{22,4}=0,25\\ a=b=0,1\\ m_{Al}=27\cdot0,1=2,7g\\ m_{Fe}=8,3-2,7=5,6g\\ a=\dfrac{3a+2b}{500}\cdot36,5=3,65\%\\ m_{ddsau}=508,3-0,25\cdot2=507,8g\\ C\%_{AlCl_3}=\dfrac{133,5a}{507,8}=2,63\%\\ C\%_{FeCl_2}=\dfrac{127b}{507,8}=2,50\%\)

\(a)n_{Mg} = a ; n_{Al} = b \Rightarrow 24a +27b = 5,1(1)\\ Mg + 2HCl \to MgCl_2 + H_2\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ n_{H_2} = a + 1,5b = \dfrac{5,6}{22,4} = 0,25(2)\\ (1)(2) \Rightarrow a = 0,1 ; b = 0,1\\ \%m_{Mg} = \dfrac{0,1.24}{5,1}.100\% = 44,44\%\ ;\ \%m_{Al} = 100\% -44,44\% = 55,56\%\\ b) n_{MgCl_2} = n_{Mg} = 0,1 \Rightarrow m_{MgCl_2} = 0,1.95 = 9,5(gam)\\ n_{AlCl_3} = n_{Al} = 0,1 \Rightarrow m_{AlCl_3} = 0,1.133,5 = 13,35(gam)\\ c)n_{HCl} = 2n_{Mg} + 3n_{Al} = 0,5(mol) \Rightarrow m_{dd\ HCl} = \dfrac{0,5.36,5}{3,65\%} = 500(gam)\)
\(m_{dd\ sau\ pư} = 5,1 + 500 - 0,25.2 = 504,6(gam)\\ C\%_{MgCl_2} = \dfrac{9,5}{504,6}.100\% = 1,89\%\\ C\%_{AlCl_3} = \dfrac{13,35}{504,6}.100\% = 2,65\%\)

Đáp án C
nAl = 0,2, nFe = 0,1 (mol)
2Al + 6HCl→ 2AlCl3 + 3H2
0,2 → 0,3 (mol)
Fe + 2HCl→ FeCl2 + H2
0,1 0,1 (mol)
V = (0,3+0,1).22,4 = 8,96 (l)

nH2 = 6,72/22,4 = 0,3 (mol)
PTHH: 2Al + 6HCl -> 2AlCl3 + 3H2
nAl = 0,3 : 3 . 2 = 0,2 (mol)
nHCl (Al) = 0,3 . 2 = 0,6 (mol)
mAl = 0,2 . 27 = 5,4 (g)
%mAl = 5,4/25,65 = 20,05%
%mZnO = 100% - 20,05% = 79,95%
mZnO = 25,65 - 5,4 = 20,25 (g)
nZnO = 20,25/81 = 0,25 (mol)
PTHH: ZnO + 2HCl -> ZnCl2 + H2O
nHCl (ZnO) = 0,25 . 2 = 0,5 (mol)
nHCl (đã dùng) = 0,6 + 0,5 = 1,1 (mol)
CMddHCl = 1,1/0,1008 = 10,9M
C% = (10,9 . 36,5)/(10 . 1,19) = 33,43%

\(n_{H_2}=\dfrac{17,353}{24,79}=0,7\left(mol\right)\\ Đặt:n_{Al}=a\left(mol\right);n_{Fe}=b\left(mol\right)\left(a,b>0\right)\\ PTHH:2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ \Rightarrow\left\{{}\begin{matrix}27a+56b=27,8\\1,5a+b=0,7\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,4\end{matrix}\right.\\ a,\%m_{Al}=\dfrac{0,2.27}{27,8}.100\%=19,424\%\\\Rightarrow\%m_{Fe}=80,576\%\\ b,n_{HCl}=3a+2b=1,4\left(mol\right)\\ m_{ddHCl}=\dfrac{1,4.36,5.100}{20}=255,5\left(g\right) \Rightarrow4\approx\approx\approx\Rightarrow FeHCm=\)

a) Gọi số mol của Al và Fe trong 13,8 gam hỗn hợp lần lượt là x và y
nH2 = 10,08:22.4= 0,45 mol
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
x ------------------------------------------>3/2x
Fe + H2SO4 → FeSO4 + H2
y ------------------------------------> y
Ta có hệ pt\(\left\{{}\begin{matrix}27x+56y=13,8\\\dfrac{3}{2}x+y=0,45\end{matrix}\right.\) => x = 0,2 và y = 0,15
=> mFe = 0,15.56 = 8,4 gam <=> %mFe = \(\dfrac{8,4}{13,8}\).100% = 60,87%
b)
X + O2 → Y
Bảo toàn khối lượng => mO2 = mY - mX = 5,76 gam <=> nO2 = 0,18 mol
Ta có sơ đồ: \(\left\{{}\begin{matrix}Fe\\Al\end{matrix}\right.\) + O2 → Y \(\underrightarrow{H_2SO_4đ,n}\) → Fe2(SO4)3 + Al2(SO4)3 + SO2 + H2O
Các quá trình oxi hóa - khử:
Fe0 → Fe+3 + 3e O20 + 4e → 2O-2
0,15 -> 0,45 0,18 --> 0,72
Al0 → Al+3 + 3e S+6 + 2e → S+4
0,2 -> 0,6 2x <- x
Áp dụng ĐLBT electron => 2x + 0,72 = 0,45 + 0,6
<=> x = 0,165
=>V SO2 đktc = 0,165.22,4 = 3,696 lít
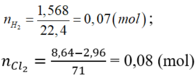
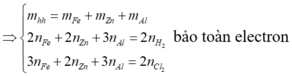
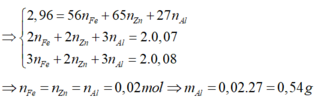
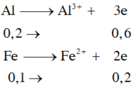
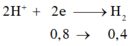
Gọi a,b lần lượt là số mol của Al, Fe trong hỗn hợp ban đầu
=> 27a+56b=8,3 (1)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25mol\)
Ta có quá trình trao đổi elcetron
\(Al^0\rightarrow Al^{+3}+3e\)
a----------------3a--(mol)
\(Fe^0\rightarrow Fe^{+2}+2e\)
b----------------2b--(mol)
\(2H^{-1}+2e\rightarrow H_2^0\)
----------0,5------0,25-(mol)
Áp dụng định luật bảo toàn e ta có: 3a+2b=0,5 (2)
Giải hệ phương trình gồm (1) và (2) ta được: \(\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\left[{}\begin{matrix}m_{Al}=0,1\cdot27=2,7g\\m_{Fe}=0,1\cdot56=5,6g\end{matrix}\right.\)