Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
![]()
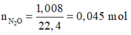
2NO−3 + 10H+ + 8e → N2O↑ + 5H2O
→ n N O 3 - ( m u ố i )
![]()
Ta thấy:
2 n N 2 O + n N O 3 - ( m u ố i ) = 0,045.2 + 0,36 = 0,45 mol < n H N O 3 =>Có muối NH4NO3.
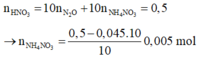
n N O 3 - ( m u ố i ) =
![]()
= 0,4 mol
![]()
![]()

Đáp án D
- Hướng tư duy 1: Bảo toàn nguyên tố N
- Quá trình:


![]()
+ Ta có
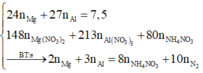
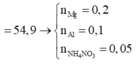
![]()
![]()
- Hướng tư duy 2: Tính theo số mol HNO3
+ Ta có
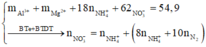
![]()
![]()

Đáp án C
Giả sử sản phẩm khử chỉ có N2
![]()
![]()
→ n N O 3 - m u ố i = 10 n N 2 = 10.0,03 = 0,3 mol
![]()
= 7,5 + 0,3.62 = 26,1 g < 54,9 g => có muối NH4NO3
![]()
m m u ố i =
![]()
![]()
![]()
= 54,9
![]()
Từ (1) và (2)
![]()
Từ (1) và (2)
![]()
![]()
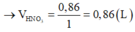

Đáp án D
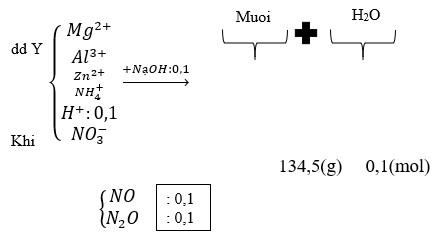
Dung dịch X + vừa đủ 0,25 mol NaOH sinh ra 0,12 mol Mg(OH)2.
+ Nhận thấy để tạo 0,12 mol Mg(OH)2 cần dùng 0,24 mol NaOH < 0,25 mol NaOH cần dùng vừa đủ.
Mà đề nói hỗn hợp M tác dụng vừa đủ với axit HNO3 ⇒ HNO3 không thể dư được.
⇒ Chỉ có 1 cách giải thích thỏa đáng đó là nNH4NO3 = 0,25 – 0,24 = 0,01 mol.
Vậy ta có sơ đồ:
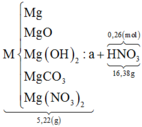
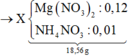
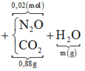
Vì 2 khí có cùng phân tử khối là 44 ⇒ mKhí = 0,02×44 = 0,88 gam.
mMuối = 0,12×148 + 0,01×80 = 18,56 gam.
Vậy bảo toàn khối lượng ta ⇒ mH2O = m = 2,16 gam ⇒ nH2O = 0,12 mol.
ĐẶt nMg(OH)2 = a và bảo toàn hiđro cả quá trình ta có:
2a + 0,26 = 0,01×4 + 0,12×2 ⇔ a = 0,01 mol.
⇒ mMg(OH)2 = 0,01×58 = 0,58 gam.
⇒ %mMg(OH)2 = 0 , 58 × 100 5 , 22 ≈ 11,11%



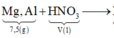
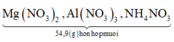
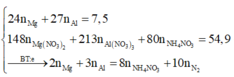
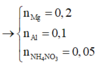


Đáp án A
Số mol N2O = 1,008/22,4 = 0,045 mol;
Số mol HNO3 phản ứng = 0,045.10 = 0,45 mol < 0,5 suy ra có tạo sản phẩm khử khác là NH4NO3
Vậy m = 8,9 + 62.( 8.0,045+8.0,005)+ 80.0.005=34,1g