Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bảo toàn electron: 15nFeS2 + 9nFeS = 2nSO2
⇒ nSO2 = 0,285 mol.
Phản ứng: 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
∑nH+ = 0,285 × 2 ÷ 5 × 2 = 0,228 mol
⇒ VY = 0,228 ÷ 10 – 2 = 22,8 lít.
Đáp án D

Cách 1: Quy đổi số oxi hóa
Sau toàn bộ quá trình, số oxi hóa cuối cùng của lưu huỳnh là +4 (trong SO2).
Giả sử S trong FeS2 và FeS đều là S + 4 .
Khi đó, có các quá trình nhường và nhận electron như sau:
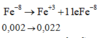
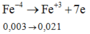
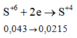

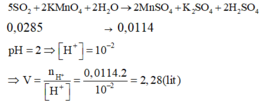
Đáp án D

Quy đổi hỗn hợp X gồm a mol Fe2O3 và b mol FeO. Do đó n F e 2 ( S O 4 ) 3 = a v à n F e S O 4 = b
Theo giả thiết a = 2b ⇒hỗn hợp X gồm 2b mol Fe2O3 và b mol FeO.
Trong 39,2 gam hỗn hợp X gồm 2b’ mol Fe2O3 và b’ mol FeO ⟹ 320b'+72b' = 39,2
⟹ b’ = 0,1 ⟹ nFeO = 0,1
![]()
⟹ V = 1,12 (lít)
Đáp án C

Đáp án B
Ta nhận thấy mE < mX => KL chưa phản ứng hết; AgNO3 và Cu(NO3)2 hết
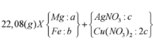
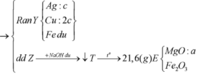
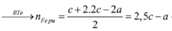
![]()
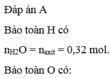
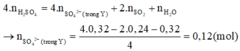


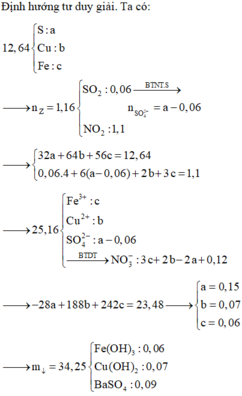



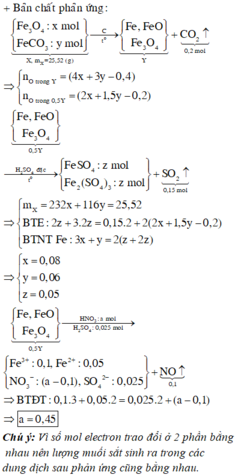
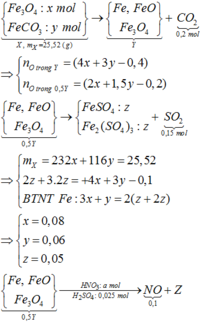
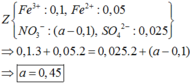
Đáp án D
Ta có :
Fe → Fe3+ + 3e
S → S+6 + 6e
S+6 + 2e → S+4
Do đó số mol SO2 là (0,05 . 3 + 0,07.6 ) / 2= 0,285 mol
5SO2 + 2H2O + 2KMnO4 → K2SO4 + 2 MnSO4 + 2H2SO4
Nên số mol H2SO4 tạo ra là 0,114 mol
=> [H+] = 0,228 : V =0,01 => V =22,8 l