Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{HCl}=\dfrac{200\cdot7.3\%}{36.5}=0.4\left(mol\right)\)
\(M+2HCl\rightarrow MCl_2+H_2\)
\(0.2.....0.4.........0.2........0.2\)
\(m_{MCl_2}=0.2\cdot\left(M+71\right)\left(g\right)\)
\(m_{dd}=0.2M+200-0.2\cdot2=0.2M+199.6\left(g\right)\)
\(C\%MCl_2=\dfrac{0.2\cdot\left(M+71\right)}{0.2M+199.6}\cdot100\%=12.05\%\)
\(\Rightarrow M=56\)
\(M:Sắt\)

1/ PT : X + 2H2O -> X[OH]2 + H2
mol : \(\frac{6}{M_X}\) -> \(\frac{6}{M_X}\)
=> mH2 = \(\frac{12}{M_X}\) => mdd = m+6 - \(\frac{12}{M_X}\)
Ta có: m+5,7 = m+6 - \(\frac{12}{M_X}\)
<=> \(\frac{12}{M_X}\)= 0,3 => MX = 40 => X là Canxi [Ca]
2/ Dặt nHCl= a [a> 0] => mddHCl= 36,5a : 14,6 x 100= 250a
PT : X + 2HCL => XCl2 + H2
mol : a/2 a -> a/2 a/2
mH2 = a/2 x 2 = a ; mX = a/2 . MX
m XCl2= a/2 x [MX +71]
mdd XCL2= a/2 .MX + 250a - a = a/2 .MX +249a
Ta có :\(\frac{\frac{a}{2}\times M_X+\frac{71}{2}a}{M_X\times a:2+249a}\times100\%=24,15\%\)
<=> \(\frac{M_X+71}{M_X+498}=24,15\%\Leftrightarrow M_X=65\)=> X là kẽm [Zn]

Gọi KL là R (KL có hoá trị n)
2R + 2nH2SO4-> R2(SO4)n + SO2 + 2nH2O
nSO2=3,36/22,4=0, 15(mol) lắp vào pt suy ra nR=0,3/n (mol).
MR=9,6.n/0,3
vì chưa biết hoá trị n nên ta lập bảng tìm hoá trị. R là KL nên có hoá trị 1, 2 hoặc 3. Cho n lần lượt bằng 1, 2,3 để tìm ra MR thoả mãn. Với n=2 thì MR=64(tm). KL là Cu
Bài 1 :Gọi KL là R (KL có hoá trị n)
2R + 2nH2SO4-> R2(SO4)n + SO2 + 2nH2O
nSO2=3,36/22,4=0, 15(mol) lắp vào pt suy ra nR=0,3/n (mol).
MR=9,6.n/0,3
vì chưa biết hoá trị n nên ta lập bảng tìm hoá trị. R là KL nên có hoá trị 1, 2 hoặc 3. Cho n lần lượt bằng 1, 2,3 để tìm ra MR thoả mãn. Với n=2 thì MR=64(tm). KL là Cu

m(HCl)=31.025x20/100=6.205
a/vì số mol H2 luôn bằng 1/2 số mol HCl (theo định luật bảo toàn nguyên tố)
Mà nHCl=0.17(mol)
=>nH2=0.17/2=0.085(mol)
=>VH2=0.085x22.4=1.904(l)
Theo định luật bảo toàn khối lượng có:
m(muối) = m(kim loại) + m(axit) - m(H2)
=2 + 6.205 - 0.085x2
=8.035(g)

Gọi CT oxit : \(R_2O_x\)
Ta có \(n_{R_2O_x}=\dfrac{3,2}{2R+16x}\left(mol\right)\)
PTHH: \(R_2O_x+xH_2SO_4\rightarrow R_2\left(SO_4\right)_x+xH_2O\) (1)
\(\dfrac{3,2}{2R+16x}\)---->\(\dfrac{3,2}{2R+16x}.x\)-->\(\dfrac{3,2}{2R+16x}\) (mol)
\(H_2SO_{4\left(dư\right)}+CaCO_3\rightarrow CaSO_4+CO_2+H_2O\) (2)
\(n_{CO_2}=\dfrac{0,244}{22,4}=0,01\left(mol\right)\)
Theo PT (2) : \(n_{CO_2}=n_{CaSO_4}=n_{H_2SO_4dư}=0,01\left(mol\right)\)
Ta có : \(m_{muối}=\text{}\dfrac{3,2}{2R+16x}.\left(2R+96x\right)+0,01.136=9,36\left(g\right)\)
\(\dfrac{3,2}{2R+16x}\).(2R+96x)=8
Lập bảng :
| x | 1 | 2 | 3 |
| R | 18,67 | 37,33 | 56 |
| Kết luận | Loại | Loại | Chọn (Fe) |
=> Oxit là Fe2O3
\(\Sigma n_{H_2SO_4}=0,02.3+0,01=0,07\left(mol\right)\)
=> \(C\%_{H_2SO_4}=\dfrac{0,07.98}{200}.100=3,43\%\)
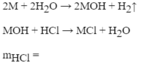
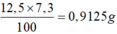

vvvvvvvvvvvvvvvvvvvvvvvvvvvvvvvv