Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1.
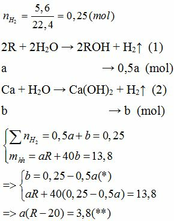
Vì b > 0, từ (*) => a < 0,25/0,5 = 0,5 thế vào (**)
=> R – 20 > 7,6
=> R > 27,6 (***)
Khi cho 8,58 gam R tác dụng với lượng dư HCl thì lượng H2 thoát ra lớn hơn 2,24 (lít)
2R + 2HCl → 2RCl + H2↑ (3)
Theo PTHH (3):
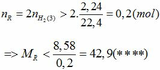
Từ (***) và (****) => 27, 6 < MR < 42,9
Vậy MR = 39 (K) thỏa mãn
2.
Ta có:
=> nKOH = nK = 0,2 (mol)
nCa(OH)2 = nCa = 0,15 (mol)
∑ nOH- = nKOH + 2nCa(OH)2 = 0,2 + 2.0,15 = 0,5 (mol)
Khi cho hỗn hợp Z ( N2, CO2) vào hỗn hợp Y chỉ có CO2 phản ứng
CO2 + OH- → HCO3- (3)
CO2 + 2OH- → CO32- + H2O (4)
CO32- + Ca2+ → CaCO3↓ (5)
nCaCO3 = 8,5/100 = 0,085 (mol) => nCO32-(5) = nCaCO3 = 0,085 (mol)
Ta thấy nCaCO3 < nCa2+ => phương trình (5) Ca2+ dư, CO32- phản ứng hết
TH1: CO2 tác dụng với OH- chỉ xảy ra phản ứng (4)
Theo (4) => nCO2 = nCO32-(4) = nCaCO3 = 0,085 (mol)
=> VCO2(đktc) = 0,085.22,4 = 1,904 (lít)
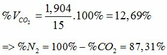
TH2: CO2 tác dụng với OH- xảy ra cả phương trình (3) và (4)
Theo (4): nCO2 = nCO32- = 0,085 (mol)
nOH- (4) = 2nCO32- = 2. 0,085 = 0,17 (mol)
=> nOH- (3)= ∑ nOH- - nOH-(4) = 0,5 – 0,17 = 0,33 (mol)
Theo PTHH (3): nCO2(3) = nOH- = 0,33 (mol)
=> ∑ nCO2(3+4) = 0,085 + 0,33 = 0,415 (mol)
=> VCO2 (ĐKTC) = 0,415.22,4 = 9,296 (lít)
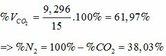

Có V1 < V2 => khi X tác dụng với H2O thì Al còn dư.
Giả sử số mol 3 kim loại là: x, y, z.
K + H2O → KOH + ½ H2↑
x → x 0,5x
Al + KOH + H2O → KAlO2 + 1,5H2↑
x ← x→ 1,5x
→ 0,5x + 1,5x = 0,2 → x = 0,1
X tác dụng với KOH: 0,1 . 0,5 + 1,5y = 0,35 => y = 0,2
Khi cho X tác dụng với H2O còn dư Al => Y chứa Al dư và Fe
nAl dư = nAl ban đầu – nAl phản ứng = 0,2 – 0,1 = 0,1mol
=> 0,1 . 1,5 + z = 0,4 => z = 0,25mol
=> m = 23,3g

Đáp án B
Phần chất rắn chưa tan là Al còn dư
Gọi n K = x mol
Cho hỗn hợp X vào nước, K phản ứng hết tạo KOH và Al phản ứng với KOH và còn dư => tính số mol theo KOH
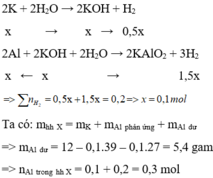
Cho hỗn hợp X tác dụng với dung dịch KOH dư => K phản ứng hết với H 2 O và Al phản ứng hết với KOH
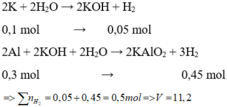

\(Ba+2HCl \to BaCl_2+H_2\\ n_{Ba}=\frac{13,7}{137}=0,1(mol)\\ n_{H_2}=n_{Ba}=0,1(mol)\\ V_{H_2}=0,1.22,4=2,24(l)\\ \text{Vậy chon đáp án C }\)

Chọn B
Cho hỗn hợp chất rắn phản ứng với HCl dư có Cu không phản ứng.
Phương trình hóa học:
F e + 2 H C l → F e C l 2 + H 2 F e O + 2 H C l → F e C l 2 + H 2 O


Bài 1 :
$n_{H_2} = 0,1(mol)$
Bảo toàn khối lượng :
$m_{H_2O} = 32 + 0,1.2 - 23,2 = 9(gam)$
$n_{H_2O} = 0,5(mol)$
X gồm $R$ và $R_2O$
$2R + 2H_2O \to 2ROH + H_2$
$R_2O + H_2O \to 2ROH$
Theo PTHH :
$n_R = 2n_{H_2} = 0,2(mol)$
$n_{H_2O} = n_R + n_{R_2O}$
$\Rightarrow n_{R_2O} = 0,3(mol)$
Ta có :
$0,2R + 0,3(2R + 16) = 23,2 \Rightarrow R = 23(Natri)$
Vậy X gồm $Na,Na_2O$
$n_{CO_2} = 0,2(mol) ; n_{NaOH} = \dfrac{6}{40} = 0,15(mol)$
Ta có :
$n_{NaOH} : n_{CO_2} = 0,15 : 0,2 = 0,75 < 1$.
Chứng tỏ sinh ra muối axit
$NaOH + CO_2 \to NaHCO_3$
$n_{NaHCO_3} = n_{NaOH} = 0,15(mol)$
$m_{muốI} = 0,15.84 = 12,6(gam)$
a, Gọi CTTQ của kim loại và oxit lần lượt là R và $R_2O$
Theo gt ta có: $n_{H_2}=0,1(mol)$
Bảo toàn e ta có: $n_{R}=0,2(mol)$
Bảo toàn khối lượng ta có: $n_{H_2O}=0,5(mol)$
$\Rightarrow n_{R_2O}=0,3(mol)$
Do đó ta có: \(0,2.R+0,3.\left(2R+16\right)=23,2\Rightarrow R=23\)
Vậy hỗn hợp X chứa Na và $Na_2O$
b, Ta có: $n_{NaOH}=0,15(mol);n_{CO_2}=0,2(mol)$
$NaOH+CO_2\rightarrow NaHCO_3$
Sau phản ứng dung dịch chứa 0,15 mol $NaHCO_3$
$\Rightarrow m_{muoi}=12,6(g)$