Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Ta có:  =>T là ancol CH3OH => Z gồm H2O và CH3OH
=>T là ancol CH3OH => Z gồm H2O và CH3OH

đều có 1 C = C trong phân tử, (n > 3, m > 4)



Với 46,6 gam E thủy phân cần: 46,6/9,32.0,11 = 0,55 mol NaOH



Chọn A.
Hỗn hợp E gồm este X: CnH2n-2O2 và axit Y: CmH2m-4O4 (m ≥ 4 và n ≥ 4).
Khi đốt cháy E:  ⇒ nO(E) = 0,22 mol; nCOO = 0,11mol
⇒ nO(E) = 0,22 mol; nCOO = 0,11mol
→ B T K L mE = mC + mH + mO = 9,32g
Trong 46,6 gam E có: nCOO = 5.0,11 = 0,55 mol ⇒ a + 2b = 0,55 (1)
và nNaOH = 0,6 mol ⇒ nNaOH dư = 0,05 mol Þ Khối lượng H2O trong dung dịch là 176 gam.
Trong Z gồm C H 3 O H : a m o l H 2 O : ( 2 b + 9 , 78 ) m o l ⇒ mbình tăng = m C H 3 O H : + m H 2 O - m H 2 = 32a + 36b = 13,4 (2)
Từ (1), (2) suy ra a = 0,25; b = 0,15
Trong 9,32 gam E có: nX = 0,05 mol ; nY = 0,03 mol
→ B T : C 0,05n + 0,03m = 0,43 ⇒ n = 5; m = 6
⇒ X là C5H8O2: 0,05 mol và C6H8O4: 0,03 mol ⇒ %mY = 46,35%

Đáp án C
Cho 200 gam NaOH chứa 0,6 mol NaOH và 176 gam H2O.
Cho 46,6 gam E tác dụng với NaOH thu được phần hơi Z chứa chất T có khối lượng phân tử là 32, vậy T là CH3OH.
Cho Z qua bình đựng Na thấy bình tăng 188,85 gam và thu được 0,275 mol H2.
BTKL: mZ = 188,85 + 0,275.2 = 189,4 gam.
Z sẽ chứa CH3OH và H2O (gồm nước của dung dịch NaOH + nước mới sinh ra).
![]()
= 13,4 gam
Gọi CTPT của X là ![]()
còn Y là 
có số mol lần lượt là a, b.
Đốt cháy lượng E thu được 0,43 mol CO2 và 0,32 mol hơi nước.
![]() .
.
= 0,32
→ a + 2b = 0,11
Gọi số mol X và Y trong 46,6 gam E lần lượt là ka và kb.
![]()
![]()
=> k = 5
Mặt khác ta có: 32.5a + 18.2.5b = 13,4
Giải được a = 0,05; b= 0,03.
Suy ra : 0,05n + 0,03m = 43
Ta nhận thấy ![]()
và ta tìm được nghiệm nguyên là n = 5, m =6.
Vậy X là ![]()
còn Y là C6H8O4.
→ %Y = 46,35%

Đáp án C
Cho 200 gam NaOH chứa 0,6 mol NaOH và 176 gam H2O.
Cho 46,6 gam E tác dụng với NaOH thu được phần hơi Z chứa chất T có khối lượng phân tử là 32, vậy T là CH3OH.
Cho Z qua bình đựng Na thấy bình tăng 188,85 gam và thu được 0,275 mol H2.
BTKL: mZ = 188,85 + 0,275.2 = 189,4 gam.
Z sẽ chứa CH3OH và H2O (gồm nước của dung dịch NaOH + nước mới sinh ra).
![]()
Gọi CTPT của X là C n H 2 n - 2 O 2 còn Y là C m H 2 m - 4 O 4 có số mol lần lượt là a, b.
Đốt cháy lượng E thu được 0,43 mol CO2 và 0,32 mol hơi nước.
![]()
![]()
→ a + 2b = 0,11
Gọi số mol X và Y trong 46,6 gam E lần lượt là ka và kb.
ka (14n + 30) + kb(14m + 60) = 46,6 <=> 14k( am+bn) + 30k( a+ 2b) =46,6 => k=5
Mặt khác ta có: 32.5a + 18.2.5b = 13,4
Giải được a = 0,05; b= 0,03.
Suy ra : 0,05n + 0,03m = 43
Ta nhận thấy m , n ≥ 4 và ta tìm được nghiệm nguyên là n = 5, m =6.
Vậy X là C 5 H 8 O 2 còn Y là C6H8O4.
→ %Y = 46,35%

Đáp án D
- Đặt u, v là số nhóm CH2 trong X, Y
Þ 0,25u = 0,15v = 1,35 Þ 5u + 3v = 27
Do u ³ 2 và v ³ 3 nên u = 3, v = 4 là nghiệm duy nhất
Þ X là C3H5COOCH3 (0,25mol), Y là C4H6(COOH)2 (0,15mol)
![]()
Gần nhất với giá trị 46,3%

Đáp án D
X và Y lần lượt có dạng CnH2n-2O2 và CmH2m-4O4 (n ≥ 3; m ≥ 4).
Ta có: nCO2 - nH2O = (k - 1).nHCHC (với k là độ bất bão hòa của HCHC).
Áp dụng: nCO2 - nH2O = nX + 2nY = nCOO ⇒ nCOO = 0,11 mol.
mE = mC + mH + mO = 0,43 × 12 + 0,32 × 2 + 0,11 × 2 × 16 = 9,32(g).
⇒ Thí nghiệm 2 dùng gấp thí nghiệm 1 là 46,6 ÷ 9,32 = 5 lần.
⇒ nCOO thí nghiệm 2 = 0,11 × 5 = 0,55 mol < nNaOH = 0,6 mol ⇒ NaOH dư.
mH2O ban đầu = 176(g). Đặt nX = x; nY = y ⇒ x + 2y = 0,55 mol.
∑mH2O/Z = 176 + 18 × 2y = 176 + 36y)(g); MT = 32 ⇒ T là CH3OH với số mol là x.
⇒ mbình tăng = 188,85(g) = 176 + 36y + 32x - 0,275 × 2
Giải hệ có: x = 0,25 mol; y = 0,15 mol.
Đặt số C của X và Y là a và b (a ≥ 4; b ≥ 4) ⇒ 0,25a + 0,15b = 0,43 × 5
Giải phương trình nghiệm nguyên có: a = 5; b = 6.
⇒ Y là C6H8O4 ⇒ %mY = 0,15 × 144 ÷ 46,6 × 100% = 46,35%

Chọn B.
Trong 200 gam dung dịch NaOH có 24 gam NaOH và 176 gam H2O
Phần hơi Z gồm T là CH3OH và H2O với 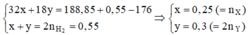
Trong 46,6 gam E chứa X (0,25 mol) và Y (0,15 mol) Þ nX : nY = 5 : 3 Þ %nY = 37,5%

Chọn D.
Giả thiết chữ E gồm X dạng C n H 2 n - 2 O 2 và Y dạng C m H 2 m - 4 O 4 (điều kiện m , n ≥ 4
*Giả đốt: E + O 2 → t o 0,43 mol CO2 + 0,32 mol H2O.
Quan sát E => quy đổi về 0,43 mol CH2 + 0,22 mol O H - → m E = 9 , 32 g a m = 46 , 6 : 5
*Phản ứng thủy phân: 46,6 gam E + 0,6 mol NaOH => chất rắn + (H2O + CH3OH).
(biết là CH3OH vì MT = 32 theo giả thiết) => có mZ = m ( H 2 O ; C H 3 O H ) = 189 , 4 g a m
(thật chú ý: bình đựng natri kín nên khối lượng bình tăng chính là khối lượng Z).
Gọi n e s t e = x m o l ; n a x = y m o l thì ∑ n C O O = x + 2 y = 0 , 55 m o l
Thủy phân cho x mol CH3OH và 2y mol H2O; tuy nhiên cần chú ý H2O trong Z còn có 176 gam H2O sẵn ở dung dịch NaOH nữa nên 189,4= 176+36y+32x=> 36y+32x=13,4 gam
Giải hệ được: x = 0,25 mol và y = 0,15 mol. Nghiệm nguyên: ![]() là C5H8O2 và Y là C6H8O4.
là C5H8O2 và Y là C6H8O4.
![]()
Chú ý: giả thiết 6,16 lít khí H2 giả thiết nhiễu, nếu không nắm rõ “bình kín” sẽ rất dễ khó khăn trong việc tìm ra đáp án

Chọn đáp án B.
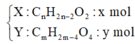
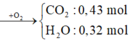
=> x+ 2y = 0,43 - 0,32 = 0,11 (1)
Có M T = 32 ⇒ là CH3OH
46 , 6 g E X : kx mol Y : ky mol + 0,6 mol NaOH
=> (14n + 30).kx + (14m + 60).ky =46,6
=> 14k.0,43 + 30k.0,11 =46,6 => k=5
Z CH 3 OH : 5 x mol H 2 O : 200 . 88 % + 18 . 5 . 2 y = ( 176 + 180 y ) g
![]()
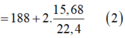
Từ (1), (2) suy ra: x =0,05 , y=0,03
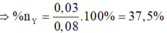
X: CnH2n-2O2: x (mol) (đk: n≥ 3)
Y: CmH2m-4O4: y (mol) (đk: m ≥ 4)
áp dụng công thức khi đốt cháy chất hữu cơ có độ bất bão hòa ta có:
(Vì X có độ bất bão hòa bằng 2 còn Y có độ bất bão hòa bằng 3)
Có: nO(E) = 2x + 4y = 0,22 (mol)
→ mE = mC + mH + mO → mE = 0,43.12 + 0,32.2 + 0,22.16 = 9,32 (g)
→ Trong 46,6 (9,32.5) gam E gọi số mol của X, Y lần lượt là 5x và 5y (mol)
→ 5x + 2.5y = 0,11.5 = 0,55 (mol)
Ta có: MT = 32 → T là CH3OH
200 g dd NaOH 12% có chứa nNaOH = 0,6 (mol) và
Phần hơi Z chứa CH3OH: 5x (mol) và H2O: 10y + 88/9 (mol)
Xét Z phản ứng với Na → 0,275 mol H2
giải hệ (1) và (2) → x = 0,05 và y = 0,03
BTNT "C": nCO2nCO2 = 0,05n + 0,03m = 0,43
→ 5n + 3m = 43
Do n ≥ 3 và m ≥ 4 và m, n nguyên nên n = 5 và m = 6 thỏa mãn
Vậy X: C5H8O2: 0,05 mol và Y: C6H8O4 : 0,03 (mol)
→ %Y = 46,35%
Đáp án cần chọn là: D