Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Giả sử có 1 mol hỗn hợp X gồm H2 và anken ![]()
Ta có:
![]()
Áp dụng định luật bảo toàn khối lượng ta có:
![]()
![]()
Phương trình phản ứng:
![]()
Ta có: nX = 1 mol; nY = 0,7 mol
![]()
![]()
Ta có: anken đó là C4H8
X phản ứng với HBr cho 1 sản phẩm duy nhất nên X là But-2-en

Đáp án A
Hướng dẫn
Giả sử có 1 mol hỗn hợp X gồm H2 và anken : CnH2n
Ta có: M - X = 9,1.2 = 18,2 ; M _ Y = 13.2 =26
Áp dụng ĐLBTKL ta có: mhhX = mhhY <=> nX. M _ X = nY. M - Y
<=> 1.18,2 = nY.26 => nY = 0,7 mol
Phương trình phản ứng: CnH2n + H2 → N i , t 0 CnH2n+2
Ta có: nX = 1 mol; nY = 0,7 mol
=> Số mol H2 pứ = số mol CnH2n = 1- 0,7 = 0,3 mol
=> số mol H2 ban đầu = 0,3 + 0,4 = 0,7 mol
Ta có: M _ X = 0,7.2 + 0,3.14n = 18,2 => n = 4 => anken: C4H8
X + HBr cho 1 sản phẩm duy nhất => X là but-2-en

Đáp án D
Có MY = 13.2 = 26 < MC2H6 =>Y chứa H2 dư
Giả sử có 1 mol X, áp dụng bảo toàn khối lượng có mY = mX = 1.9,1.2 = 18,2 gam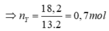
=>nH2 phản ứng = nX - nY = 1 - 0,7 = 0,3 mol
=>nanken = nH2 phản ứng = 0,3 mol, nH2 trong X = 1 - 0,3 = 0,7 mol![]()
Mà anken cộng HBr cho sản phẩm hữu cơ duy nhất
=>CTCT của anken là:CH3-CH=CH-CH3.

Gọi anken là: CnH2n
Áp dụng định luật bảo toàn khối lượng ta có: mX = mY
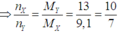
Giả sử nX = 10 mol ; nY = 7 mol;
Y không làm mất màu nước brom ⇒ Y không có anken, anken tham gia phản ứng hết
nhỗn hợp khí giảm = nH2 pư = n Anken = 10 – 7 = 3 mol
⇒ n H2/X = 10 – 3 = 7 mol
mX = m H2 + m anken = nX. MX = 10 .18,2 = 182g
⇒ 7.2 + 14n.7 = 182 ⇒ n = 4
⇒ Anken là C4H8
Mà anken có khả năng cộng HBr cho sản phẩm hữu cơ duy nhất
⇒ Anken là CH3-CH=CH-CH3 .
Đáp án A.

Đáp án B
Hướng dẫn
Gọi số mol hổn hợp X là 1mol
Ta có M - X = 9,1. 2 = 18,2 à mX = 18,2. 1 = 18,2 g = mY
Mà M - Y = 13. 2 = 26 à nY = 18,2/26 = 0,7 mol
à nH2 pư = 1 – 0,7 = 0,3 mol = nanken à nH2 bđ = 0,7 mol
Manken = 18 , 2 - 0 , 7 . 2 0 . 3 = 14n à n = 4 à CTPT của anken là C4H8
Anken có khả năng cộng HBr cho sản phẩm hữu cơ duy nhất => CTCT của anken là: CH3-CH=CH-CH3

Đáp án D
hhX gồm H2 và C2H4 có dX/He = 3,75.
Dẫn X qua Ni, to → hhY có dY/He = 5.
• Đặt nH2 = x mol; nC2H4 = y mol.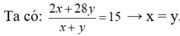
Đặt nH2 = 1 mol; nC2H4 = 1 mol.
Giả sử có x mol C2H6 tạo thành → hhY gồm C2H6 x mol; H2 (1 - x) mol và C2H4 (1 - x) mol.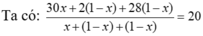
→ x = 0,5 → H = 50%

Đáp án C
Hướng dẫn Ta có : M - X = 4. 3,75 = 15
C 2 H 4 28 13 \ / 15 / \ H 2 2 13
→ n C 2 H 4 n H 2 = 1 1
Vậy hiệu suất tính theo anken hoặc H2 củng được
Giả sử: nX = 1mol → mX = 15. 1 = 15 g = mY
Mà M - Y = 5. 4 = 20 → nY = 15/20 = 0,75 mol → nH2 pư = 1 – 0,75 = 0,25 mol
→ H = 0 , 25 0 , 5 .100% = 50%

Giả sử nX =1
Có nH2 + nC2H4 = nX = 1
2nH2 + 28nC2H4 = mX = 3,75.4 = 15
⇒ nH2 = nC2H4 = 0,5
Đặt nC2H4 phản ứng = a ⇒ nH2 phản ứng = a.
⇒ nY = nX – nH2 phản ứng = 1 – a
MY = 5.4 =20
mY = mX =15 ⇒ nY = 15 : 20 =0,75 ⇒ a = 1- 0,75 = 0,25
⇒ H = 25%
Đáp án B.

1)Hỗn hợp khí A : CnH2n (b mol ) và H2 ( a mol )
d A/H2 = 9,1 => MA/MH2 = 9,1 (1)
Không làm mất màu Brom đó là Ankan
CnH2n + H2 -(Ni , t°)-> CnH2n+2
b ---------> b ----------> b (mol)
Hỗn hợp khí B là : CnH2n+2 ( b mol ) và H2 dư ( a - b ) (mol)
d B/H2 = 13 => MB/MH2 = 13 (2)
Từ (1) , (2) => MA / 9,1 = MB / 13
<=> mA / nA.9,1 = mB / nA.13
Mà định luật bảo toàn khối lượng : mA = mB
<=> nA.9,1 = nB.13
<=> (a + b).9,1 = (a - b + b ).13
<=> 9,1a + 9,1b = 13a
<=> 9,1b = 3,9a
<=> a = 7/3b
Mà MA = (14n.b + 2a) / a + b = 9,1 x 2 = 18,2
<=> 14nb + 14/3b / 7/3b + b = 18,2
<=> 14b(n + 1/3) / 10/3b = 18,2
<=> 21/5(n + 1/3) = 18,2
<=> n + 1/3 = 13/3
<=> n = 4
=> Đó là C4H8
Mà khả năng cộng với HBr ra 1 sản phẩm duy nhất.
CH3 - CH = CH - CH3
3 sd PP đường chéo => n H2 : n C2H4 = 1:1,
coi n H2 = n C2H4 = 1 mol
g/s sau P.ư tọa ra a mol C2H6
=> n H2 = n C2H2 = 1-a
khối lượng TB M=m/n=20 giải ra => a=0,5
=> H=50%