Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol Mg (x); Fe trong Y là y và Fe trong Z là z
Ta có:
24x + 56y + 56z = 9,2
2x + 3y + 2z = 0,57 ( Bảo toàn e)
40x + 80z = 8,4
⇒ x = 0,15 ; y = 0,07 ; z = 0,03
%Fe = (0,1.56.100)/9,2 = 60,87%
Đáp án D

Đáp án C

- Giả sử Mg, Fe đều phản ứng hết với muối kim loại => Z chứa toàn bộ số mol Mg2+ ; Fex+
=> T chứa Mg(OH)2 và Fe(OH)x => Chất rắn cuối cùng là MgO và Fe2O3 chắc chắn phải có khối lượng lớn hơn lượng kim loại ban đầu trong X => Không thỏa mãn đề bài (7,2 < 7,36)
=> Các muối nitrat phản ứng hết, kim loại dư và đó là Fe (vì Mg phản ứng trước)
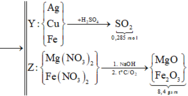
=> kết tủa Y gồm Cu, Ag, Fe.
- Gọi nMg = a ; nFe(pứ) = b ; nFe dư = c => mX = 24a + 56b + 56c = 7,36 (1)
- Bảo toàn e cho phản ứng trao đổi muối: 2nMg + 2nFe pứ = nAg + 2nCu = 2a + 2b
- Khi Y + H2SO4 đặc nóng (Fe → Fe3+)
Bảo toàn electron: 2nCu + nAg + 3nFe dư = 2nSO2 = 2.5,04/22,4 = 0,45 mol
=> 2a + 2b + 3c = 0,45 (2)
- Như đã phân tích ở trên. chất rắn cuối cùng gồm MgO và Fe2O3.
Bảo toàn nguyên tố: nMg = nMgO = a ; nFe2O3 = ½ nFe pứ = 0,5b
=> mrắn = mMgO + mFe2O3 = 40a + 160.0,5b = 40a + 80b = 7,2 (3)
Từ (1,2,3) => a = 0,12 ; b = 0,03 ; c = 0,05 mol
=> mFe(X) = 56.(0,03 + 0,05) = 4,48g
=> %mFe(X) = 4,48: 7,36 = 60,87%

Chọn A.
Rắn Y chứa 3 kim loại là Ag, Cu, Fe (z mol) và dung dịch Z chứa Mg(NO3)2 (x mol) và Fe(NO3)2 (y mol) Ta có:
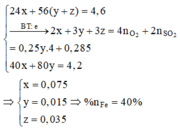

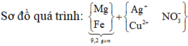

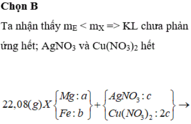
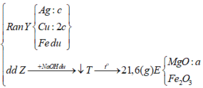
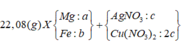
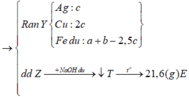
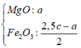
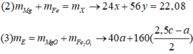
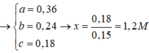
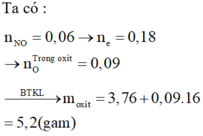


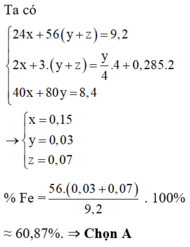
Đáp án : D
Gọi hỗn hợp X với số mol lần lượt : x mol Al ; y mol Fe ; z mol Mg
=> Bảo toàn e : 3x + 3y + 2z = 3nNO = 1,2 mol (1)
.mX = 27x + 56y + 24z = 15,5g (2)
Xét 0,05 mol X với lượng chất gấp t lần trong 15,5g X
=> t.(x + y + z) = 0,05 mol
Khi cho NaOH dư vào dung dịch Z => kết tủa chỉ gồm Fe(OH)3 ; Mg(OH)2
Nhiệt phân tạo 0,5y mol Fe2O3 và z mol MgO
=> 2g = (80y + 40z).t
=> x + y + z = 2y + z => x = y (3)
Từ (1),(2),(3) => x = y = 0,1 ; z = 0,3 mol
=> %mAl = 17,42% ; %mFe = 36,13% ; %mMg = 46,45%