Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích: Đáp án D
Hợp kim Fe – Zn khi bị ăn mòn, Zn sẽ bị ăn mòn trước

Đáp án D
Trong pin điện, các quá trình ở hai điện cực là:
Anot: quá trình oxi hóa (quá trình nhường e)
Catot: quá trình khử (quá trình nhận e)

Zn là kim loại mạnh hơn ⇒ đóng vai trò là cực âm (anot)
⇒ Zn → Zn2+ + 2e.
Ở cực dương (catot) xảy ra quá trình khử: O2 + 2H2O + 4e → 4OH–.
Đáp án D

Đáp án D
Zn có tính khử mạnh hơn nên ở cực
âm(anot): Zn → Zn2+ + 2e : quá trình oxi hóa Zn

Đáp án B
Nhận xét đúng là : Tinh thể sắt là anot, xảy ra quá trình oxi hoá.
Giải thích :
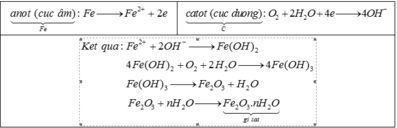

Đáp án B
Điều kiện để ăn mòn điện hóa :
+ 2 thanh điện cực khác bản chất (KL-KL, KL-PK,…)
+ 2 điện cực nối với nhau bằng dây dẫn hoặc tiếp xúc trực tiếp
+ Cùng nhúng vào 1 dung dịch chất điện ly
=> Các thí nghiệm thỏa mãn : (2) [Fe-Cu] , (3) [Cu-Ag] , (4) [Fe-Sn] , (5) [Fe-C]

Điều kiện để ăn mòn điện hóa :
+ 2 thanh điện cực khác bản chất (KL-KL, KL-PK,…)
+ 2 điện cực nối với nhau bằng dây dẫn hoặc tiếp xúc trực tiếp
+ Cùng nhúng vào 1 dung dịch chất điện ly
=> Các thí nghiệm thỏa mãn : (2) [Fe-Cu] , (3) [Cu-Ag] , (4) [Fe-Sn] , (5) [Fe-C]
Đáp án B
Đáp án C
Tại catot xảy ra quá trình : O 2 + 2 H 2 O +4e → 4 OH - .